对于患有罕见遗传病的人们来说——其中许多疾病可能会使人衰弱或危及生命——对创新疗法的需求迫在眉睫。在 7,000 种已知的罕见病中,只有 5% 有获批的疗法,这使得罕见病患者群体成为当今医学界最缺乏服务的群体之一。最终,充分发挥基因疗法治疗罕见遗传病潜力的能力取决于倾听和解决患者的需求。辉瑞旨在建立一种新的范例;通过在创新的每个阶段都纳入患者的声音,并利用公司在罕见病研究方面的专业知识来开发一系列可能具有变革性的基于重组腺相关病毒 (rAAV) 的基因疗法,从而引领将新药带给罕见病患者的道路。
罕见病的全球集体影响
在美国,罕见病被定义为影响人数少于 20 万人的疾病,在欧盟,罕见病被定义为影响人数不超过 2000 分之一的疾病,其中约 80% 是由基因突变引起的。大约一半的罕见病主要影响婴幼儿和儿童,并可能导致严重的疾病和过早死亡。虽然每种遗传病可能发生在少数患者群体中,但总体而言,罕见病影响着全球约 4 亿人,并造成严重的健康、生命和经济潜力损失。少数可用的治疗方法通常侧重于疾病症状,而没有纠正疾病的根本原因。
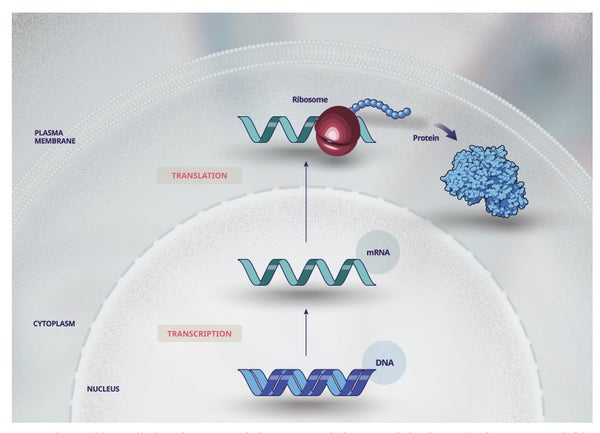
罕见遗传病的症状和健康影响各不相同,但大多数疾病会导致细胞和器官正常功能所需的蛋白质丢失或改变。我们的基因编码在染色体的 DNA(脱氧核糖核酸)中,染色体位于细胞核内(图 1),包含制造我们身体保持健康所需的所有蛋白质的指令。DNA 被复制(转录)成 RNA(核糖核酸),RNA 离开细胞核并将这些指令传递给细胞核外的蛋白质制造机制(核糖体)。
遗传性疾病是由 DNA 代码(突变)的遗传性或自发性变化引起的。这些变化可能导致蛋白质功能丧失或获得毒性功能,并随后改变细胞功能。恢复蛋白质表达功能模式的基因药物在治疗罕见病方面具有广阔的前景。治疗方法包括基因疗法(美国基因和细胞治疗协会将其定义为将遗传物质——特别是 DNA 或 RNA——引入、移除或改变到患者的细胞中以治疗特定疾病,尽管其他来源可能使用不同的定义)、基因编辑(永久性纠正、阻止或改变患者自身 DNA 内的突变)和基因调控(改变基因转录为 RNA 或 RNA 翻译为蛋白质)。
基因疗法有可能解决罕见病的根本原因
基因疗法代表了治疗药物开发的下一步发展,它始于治疗症状的化合物(例如,阿司匹林治疗疼痛),然后发展到改变疾病的生物疗法(可能包括蛋白质和抗体)(例如,酶替代疗法治疗某些先天性代谢缺陷,如戈谢病)。现在,基因疗法提供了解决罕见遗传病潜在生物学问题的潜力,这可以减少持续治疗的需求,从而减轻患者的治疗负担并降低医疗系统的需求。它还可以提高护理人员,尤其是父母的生活质量,他们今天面临着巨大的情感、身体和经济挑战。使患者能够活得更长寿、更健康、更有效率,可能会进一步提高他们为社会和经济做出积极贡献的能力。
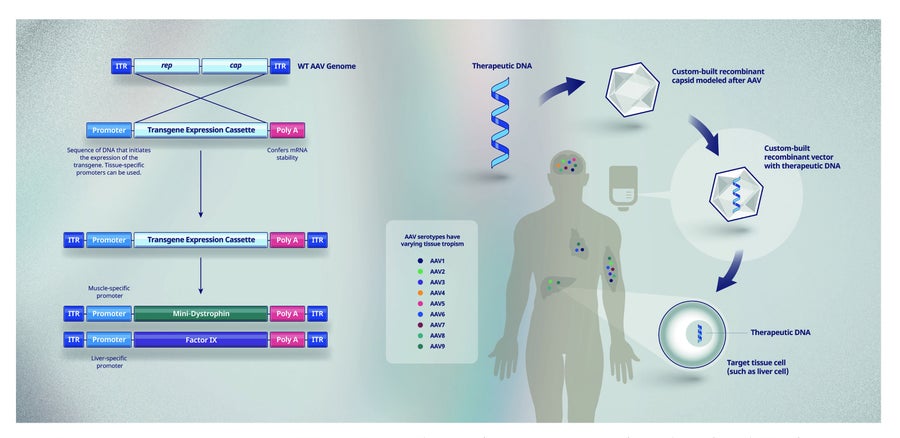
图 2. 使用体内 rAAV 基因疗法从基因到蛋白质。从野生型 (WT) 腺相关病毒 (AAV) 基因组中移除 rep 和 cap 基因,并替换为表达盒,该表达盒包括治疗性转基因、在靶细胞类型中开启基因所需的启动子序列以及赋予 mRNA 稳定性的 Poly A 序列。杜氏肌营养不良症和血友病 B 的基因疗法分别使用编码微型肌营养不良蛋白和 IX 因子的转基因。然后将这些治疗性 DNA 与 rAAV 衣壳结合,以创建 rAAV 载体,该载体通过输注或注射(取决于靶组织)递送给患者。ITR - 野生型 AAV 基因组的倒末端重复序列,允许转基因在生产过程中复制。
创新对于实现基因疗法的承诺至关重要
我们的身体有多种系统来阻止外来物质和 DNA 进入我们的细胞。安全有效地将健康基因转移到细胞(图 2)需要能够绕过这些系统并使健康基因在受疾病影响的特定细胞中长期表达的递送方法。
将无害病毒变成基因疗法的强大载体
腺相关病毒 (AAV) 可以被改造,使其自身的病毒基因组被 DNA 取代,DNA 包含基因的功能性拷贝(称为转基因)和一个在特定类型的细胞中开启基因的开关(称为启动子),这些细胞是治疗特定疾病所必需的。AAV 外壳(衣壳)内部的工程 DNA 组合称为载体(图 2)。
工程重组 AAV 载体是目前研究性基因治疗临床试验中最常见的递送系统,原因有几个。从安全角度来看,AAV 不会引起人类疾病,并且在没有其他病毒的帮助下无法自我复制。这意味着 rAAV 载体无法在人体内复制。rAAV 载体递送的健康基因也主要与患者自身的 DNA 分开,这有助于防止产生额外的突变,如果突变插入患者染色体的某些位置,可能会发生这种情况。rAAV 载体有可能提供健康基因的长期表达,并且多种 AAV 毒株(称为血清型)能够开发 rAAV 载体,这些载体旨在优先靶向治疗特定疾病所需的细胞(图 2)。此外,rAAV 载体可以通过输注或注射(称为体内基因疗法)直接递送给患者。重要的是,rAAV 载体已用于美国和欧洲批准使用的基因疗法中,证明了它们的可行性。由于所有这些原因,辉瑞将 rAAV 载体用于体内基因疗法,作为其罕见病基因疗法的主要方法。
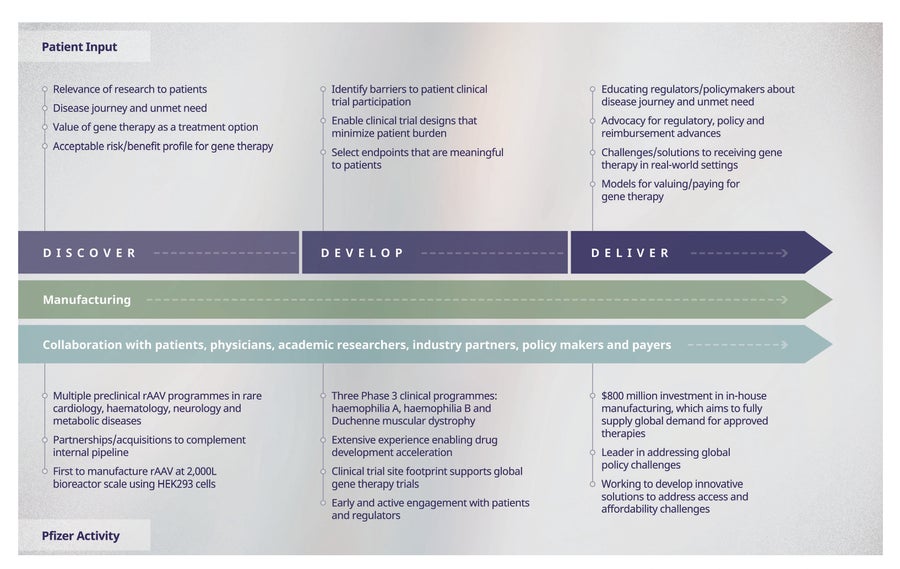
图 3. 辉瑞端到端、以患者为中心的基因疗法开发方法。辉瑞的基因疗法方法涵盖发现、开发和交付。各阶段的患者参与;辉瑞各阶段的活动;生产和合作是端到端关键。
辉瑞的端到端 rAAV 基因疗法平台
辉瑞已建立我们认为是行业领先的端到端(从发现到开发和交付)基因疗法平台,以帮助实现基因疗法在治疗各种罕见遗传疾病方面的潜力,并确保在开发的每个阶段都考虑到患者的需求和观点(图 3)。这个端到端平台利用辉瑞广泛的罕见病药物开发专业知识来推进基因疗法的开发时间表,支持全球基因疗法试验,并尽早与患者互动以了解他们的需求。这种方法促成了业内最大的 3 期基因疗法项目产品线之一(血友病 A、血友病 B 和杜氏肌营养不良症)以及罕见血液学、神经病学、心脏病学和内分泌/代谢疾病的多个临床前项目。
发现
在发现阶段,辉瑞科学家评估特定基因突变在疾病中所起的作用。然后,他们确定将健康基因拷贝传递到正确细胞以治疗疾病的最佳方法。他们还确定是否存在年龄或疾病阶段,在此之前或之后基因疗法不太可能有效。例如,杜氏肌营养不良症早期出现,进展迅速,并随着时间的推移导致肌肉损伤和衰竭。在这种和其他进行性疾病中,基因疗法在儿童时期给药可能预防严重的和不可逆转的损伤,在老年患者给药可能预防进一步的衰退。
在开发阶段会发生各种活动,包括进行临床试验,这些试验优先考虑参与患者的安全,并提供患者、医生、监管机构和其他利益相关者做出知情批准和治疗决策所需的安全性和有效性数据。在设计实现这些目标的试验时,需要考虑几个重要因素。一个考虑因素是确定哪些患者最有可能从正在测试的基因疗法中获益,如上所述,这可能取决于多种因素。另一个考虑因素是针对可能已经对 AAV 产生抗体的患者的方法。由于 AAV 是一种天然存在的病毒,许多人已经接触过它,他们的免疫系统已经被启动以阻止 AAV(和相关的 rAAV 载体)进入细胞。其中一些抗体可以阻止 rAAV 载体进入细胞(称为中和抗体或 NAbs)。显著水平的 NAbs 可能会阻止 rAAV 基因疗法进入足够的细胞以产生治疗效果。因此,许多 rAAV 临床试验目前排除 NAbs 水平高于一定值的患者。从安全角度来看,对 AAV 的免疫反应可能会导致与 rAAV 载体相关的不良反应。为了降低这种风险,rAAV 基因疗法临床试验通常包括临时使用减少宿主免疫反应的药物,并制定了监测和应对这些事件(如果发生)的流程。
对潜在疗法是否提供益处的评估是通过测量特定临床试验评估的变化来确定的,这些评估被称为终点。终点可以包括递送基因产生的治疗性蛋白质水平的变化(例如,血友病 A 和 B 的 VIII 因子或 IX 因子,或杜氏肌营养不良症的微型肌营养不良蛋白)、身体功能的变化,如步行速度或爬楼梯能力(杜氏肌营养不良症)、血友病出血率以及患者自身对疾病生活如何因治疗而改变的看法。选择对患者重要且可以一致且可重复测量的终点可能具有挑战性,特别是对于尚未就如何定义“益处”达成共识的疾病。因此,与患者、临床医生和监管机构协商对于选择对患者有意义、可以在临床实践中一致使用并为监管机构提供评估和可能批准新疗法所需信息的终点至关重要。最后,创建注册表以收集接受新基因疗法(一旦获得批准)的患者的长期数据,对于多年来持续评估安全性和有效性非常重要。
开发
开发阶段还包括与监管机构合作,以建立潜在产品批准的途径,该途径在强大的安全性和有效性数据需求与通常迫切需要的新疗法之间取得平衡。这是一个复杂的过程,需要监管机构、患者、患者权益倡导团体、行业和学术界之间的有效合作。全面的监管策略还需要反映不同全球监管机构的优先事项和流程。作为一家在发现、开发和向全球患者交付疗法方面拥有 170 多年成功经验的公司,辉瑞正在利用其监管专业知识来支持其罕见病基因疗法产品线。它还参与合作努力,以协调不同国家和地区的监管要求,从而简化罕见病基因疗法的批准,并确保尽可能快速和广泛地获得批准的疗法。
交付
交付阶段包括旨在确保批准的基因疗法能够惠及可能从中受益的患者的活动。这包括与付款人和政策制定者进行创新性合作,以开发新颖的解决方案,确保患者获得可能提供多年或患者终生益处的潜在的一次性疗法。管理供应链物流和教育医疗从业人员对于促进基因疗法交付到患者的社区护理机构至关重要,并使患者免受长途跋涉到专门治疗中心的负担。扩大基因检测的范围以实现罕见遗传病的早期诊断对于基因疗法的交付也很重要。对于早期治疗可能提供最大益处的快速进展性疾病尤其如此。
在整个发现、开发和交付过程中,辉瑞积极与患者互动。在发现阶段,患者的见解阐明了科学家对罕见遗传病如何影响他们日常生活的理解,他们疾病症状的哪些类型的变化或改善对他们最有意义,以及他们愿意接受或不接受哪些风险以实现这些变化。在整个临床和监管开发过程中,患者的意见可以通过识别参与障碍并确定哪些测量被认为是重要的并且应该用于确定新疗法是否有效,从而帮助优化临床试验设计。患者在确保批准的疗法能够轻松交付方面也发挥着重要作用,他们可以帮助教育监管机构、政策制定者和付款人了解他们的需求以及新疗法可能为他们及其护理人员提供的潜在价值。
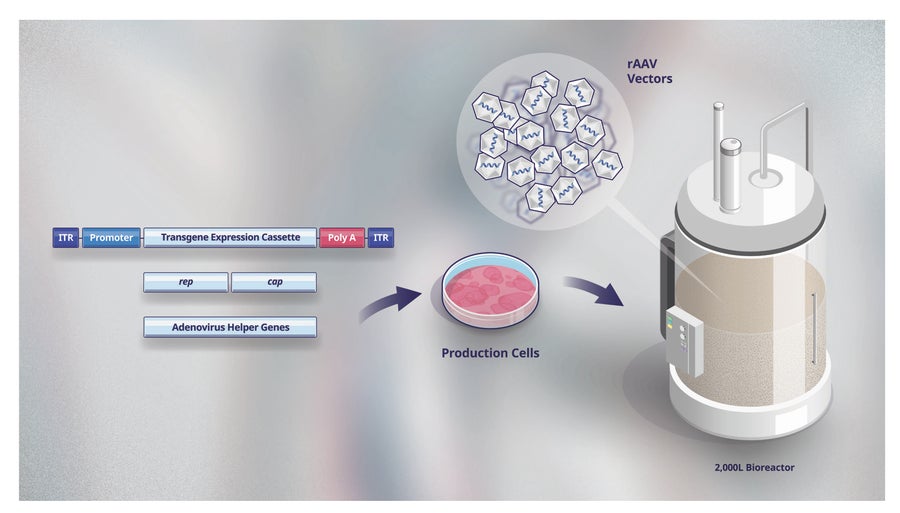
图 4. 辉瑞 rAAV 三重转染生产工艺的组成部分。辉瑞生产其每种 rAAV 基因疗法候选药物的工艺需要生产细胞系和三种不同的组分(称为三重转染):载体携带的遗传物质(转基因)、载体的关键复制和结构蛋白 (rep 和 cap) 以及辅助复制和组装过程的其他(辅助)蛋白。所有三种组分都被引入生产细胞系(如 HEK293 或其他已建立的细胞系)。转染的细胞在生物反应器中培养,在那里进行 rAAV 载体生产。
卓越的生产支持成功
研究性罕见病疗法的临床试验通常包括比大型疾病适应症更少的患者数量,这可能会导致临床开发时间表缩短。因此,这些疗法的生产工艺需要比其他类型的疗法更短的时间内建立和批准。这可能会导致监管机构对基因疗法生产规范的疑问多于对其他类型的在研药物的疑问。基因疗法生产的监管环境也因关键监管要求的许多方面仍在不断完善而变得复杂。此外,监管要求可能因监管机构而异,这增加了尝试使这些新型疗法(如果获得批准)在全球范围内广泛可用的复杂性。
与其他生物制品的生产一样,此过程的第一步是开发所谓的生产细胞系(图 4)。生产细胞充当制造 rAAV 载体的微型工厂。一旦创建了生产细胞系,细胞就会在培养物中生长并转染,以产生数万亿个 rAAV 载体,具体取决于疾病适应症。治疗肌肉等组织所需的 rAAV 载体数量(遍布全身)比治疗视网膜疾病所需的数量大数万倍,对于视网膜疾病,rAAV 载体可以直接注射到视网膜中。
辉瑞使用大型容器(也称为生物反应器,图 4),就像用于生产公司其他生物疗法一样。必须裂解生产细胞,以将 rAAV 载体释放到细胞生长的生长培养基中。收集液体并在几个步骤中进行处理,以去除任何细胞碎片或其他生产副产品或杂质。还使用其他步骤来减少不包含健康基因的“空”载体的数量。这些多重纯化步骤(每个步骤都包括质量控制测试)产生高质量的 rAAV 载体产品,然后将其包装用于冷链运输和交付。随着基因疗法候选药物从发现阶段到临床试验的推进,以及已批准的基因疗法产品(将需要能够满足全球患者需求的持续生产)的推进,生产需求增加。
辉瑞在支持其基因疗法产品线方面开发的包装和冷链供应链管理方面的专业知识,在其快速开发和部署冷链流程以在全球范围内交付辉瑞-BioNTech COVID-19 疫苗的能力中发挥了关键作用。从疫苗部署中获得的额外见解正在被纳入其基因疗法候选药物的创新冷链管理流程中。有望实现比传统生物疗法方法更高效的 rAAV 基因疗法交付流程(如果获得批准)。
辉瑞的端到端 rAAV 生产工艺建立在公司生产其他生物疗法的专业知识之上,以生产高质量的载体,这些载体可以扩展以满足其基因疗法候选药物的开发阶段和给药要求。这种专业知识对于防止基因疗法候选药物从临床试验开发到全球交付以及跨越广泛剂量范围的监管延误至关重要。该公司已建立多元化的生产基础设施,以支持从端到端开发到未来交付其基因疗法候选药物,其中包括位于美国北卡罗来纳州莫里斯维尔、达勒姆和桑福德的尖端生产设施。总而言之,这些设施以小规模(10-250 升)提供符合良好实验室规范级别的材料,用于研究和开发活动,并以各种规模提供符合良好生产规范级别的材料,用于早期(500 升)和关键临床(2,000 升)试验,并最终满足全球患者需求。每个规模生产的剂量数量取决于疾病适应症。
辉瑞实现 rAAV 基因疗法治疗罕见病潜力的道路
辉瑞正在进行多项内部和合作努力,以支持基因疗法的发展。
推进科学
科学家们正在创新新型 rAAV 载体,这些载体可能更有效地进入靶细胞和/或产生更多这些载体编码的健康蛋白质。研究人员还在探索多种方法来减少对 rAAV 载体的潜在免疫反应,这对于提高患者首次给药的安全性和有效性,以及在未来需要时可能使患者能够接受额外剂量非常重要。其中一种方法是血浆置换术,其中患者的血液通过外部设备进行处理,以在施用 rAAV 基因疗法之前去除 NAbs。预计这将防止免疫系统阻止 rAAV 载体进入靶细胞。另一种方法是施用暂时阻止免疫系统产生针对 rAAV 载体的新抗体的药物。这也可能增加在初始给药期间到达其靶细胞的 rAAV 载体的数量,同时阻止可能降低未来剂量效率(如果需要)的抗体的产生。目前用于降低某些移植患者抗体水平(包括 NAbs)的药物的临时使用也可能在降低基因疗法患者对 rAAV 载体的抗体反应方面提供益处。
这些干预措施的可用性可能允许纳入原本可能因对 AAV 载体存在高水平预先存在的 NAbs 而被排除在基因疗法之外的患者。此外,虽然来自已批准和研究性 rAAV 基因疗法的数据表明治疗性蛋白质表达具有良好的持久性,从而具有作为一次性疗法的潜力,但在某些疾病或某些患者中,理论上可能需要第二甚至第三剂。辉瑞正在探索多种方法,包括使用联合干预措施,以减少对 rAAV 载体的免疫反应,这对于支持初始剂量的长期表达以及在必要时实现再次给药至关重要。
扩大全球监管能力
目前的基因疗法批准速度低于预期,在许多情况下是由于监管复杂性。减少监管延误需要制定和实施关于临床试验设计和终点的一致和标准指南,以及基因疗法生产所用化学、生产和控制指南的清晰性。确保全球患者都能获得新的基因疗法还需要全球整合和协调监管指南,以及监管机构和基因疗法研究人员之间早期和富有成效的沟通。辉瑞正在利用其全球监管专业知识,并与科学组织、行业、监管机构以及全球其他机构合作,以应对基因疗法面临的监管挑战。
开发创新的准入模式
罕见遗传病的传统疗法在患者的一生中使用,目前的报销政策和支付模式并非旨在适应可能仅给药一次或几次的基因疗法。辉瑞正在与政府和付款人合作,开发创新的政策和准入模式,以承认基因疗法在患者一生中可能提供的潜在健康、经济和社会效益,并减少获得潜在变革性疗法的经济和其他障碍。
rAAV 载体在实现患有罕见病患者的新型变革性疗法方面的潜力已得到验证。充分实现这一潜力需要在所有利益相关者之间持续推进和创新整个发现、开发和交付的连续过程。
有关辉瑞罕见病疗法产品组合的更多信息,请访问 https://www.pfizer.com/science/rarediseases/;有关辉瑞基因疗法项目的信息,请访问 https://www.pfizer.com/science/researchdevelopment/ gene-therapy。