本文发表于《大众科学》的前博客网络,反映了作者的观点,不一定反映《大众科学》的观点
你是否曾经好奇过你服用的药物——它们是如何被研发和生产出来的?我们将在“分子到药物”系列中探索这些问题。这个新系列可以被看作是“面向普通人的医学科普”,旨在揭开临床研究和药物研发的神秘面纱,并提供背景信息,以便患者和医生都能更明智地决定是否愿意参与临床试验。
为什么要关注?
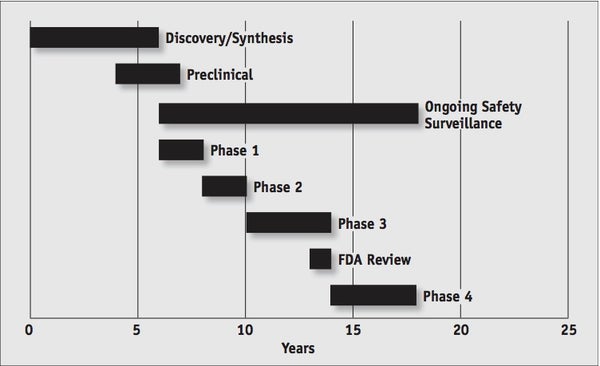
从化学物质被发现到最终进入药店,一种药物的研发平均需要 12-15 年,并且需要成千上万的志愿者参与临床试验过程(图 1)。
关于支持科学新闻报道
如果您喜欢这篇文章,请考虑通过以下方式支持我们屡获殊荣的新闻报道: 订阅。通过购买订阅,您将帮助确保有关塑造我们今天世界的发现和想法的具有影响力的故事的未来。
很少有人参与临床试验——癌症患者的参与率甚至低于 5%——原因是缺乏对该过程的认识或了解。我们将在后续文章中详细介绍药物是如何研发出来的。
志愿者人数不足是药物研发的主要瓶颈之一,延缓了产品的发布和对公众的用处。当然,如果许多人患有尚无其他治疗方法的疾病,他们可能会在这个等待期间遭受痛苦甚至死亡。因此,如果您想要新药,请了解——并决定您是否愿意参与——这个过程。我曾以志愿者、研究人员和倡导者的身份参与其中。
为什么要进行临床试验?
人们自然而然地想要找到能让他们感觉更好的东西。因此,人们调制了药剂,有时被称为“专利药”。但后来有人问,这种药是否真的有效,或者除了预期用途之外,这种药还有什么作用。后来问题变得更加复杂,询问该药物是否可能对患有特定疾病的人或正在服用其他药物的人有害。或者药物是如何起作用的?如果它通过特定的机制起作用,这是否表明它可能对另一种疾病有用?是否还有其他意想不到的后果?因此,这些以及更多问题,就是进行临床试验的原因。
临床试验是如何产生的
为了理解为什么试验以某些方式进行,了解它们是如何演变的会很有帮助——也很有趣。
早在圣经时代就有关于实验的描述,丹尼尔以豆类和水为食,代替肉和酒。其他人也效仿,观察接受治疗组之间的差异。但首次已知的前瞻性对照临床试验发生在 1747 年,当时詹姆斯·林德给水手们提供了不同的膳食补充剂,以努力预防坏血病,这是一种因维生素 C 缺乏引起的疾病。虽然他证明了疗效,但林德没有获得参与者的同意,导致他的研究也获得了因伦理理由而受到批评的 dubious honor。
天花(一种现在已被消除的毁灭性病毒感染)的流行在 1700 年代和 1800 年代很常见。1796 年,爱德华·詹纳证明,用牛痘(一种相关的但较温和的疾病)制成的疫苗可以用来预防天花。在美国,人们试图从英国进口的牛痘痂中开发疫苗。由于牛痘病毒无法在干燥的痂中存活很长时间,因此通过连续的人与人之间的接种来繁殖病毒:刮取一个人身上的感染性疫苗接种病变,并用作接种下一个人的材料来源。
国会授权必须维持充足的未受污染的牛痘供应,并向任何公民提供疫苗。根据 1813 年的《疫苗法案》,巴尔的摩医生詹姆斯·史密斯博士通过每 8 天进行一次人与人之间的传播,繁殖牛痘长达 20 年。不幸的是,1821 年,史密斯博士错误地将天花结痂而不是牛痘疫苗寄往北卡罗来纳州,引发了天花疫情,以及随后 1813 年《疫苗法案》的废除。
除了用活天花病毒而不是减毒(弱化)牛痘疫苗接种人的这个离谱错误之外,人与人之间的接种也经常传播其他传染病以及牛痘疫苗,从而削弱了人们对疫苗接种工作的热情。(这很好地说明了意外后果定律;幸运的是,这种人与人之间的传播不再进行了)。
许多法律随后都是被动地通过的,以应对悲剧,而不是主动地防止问题的发生。
例如,在墨西哥作战的美国军队收到了无效的、伪造的疟疾药物后,1848 年通过了《进口药品法案》,建立了海关实验室,以验证药物的真伪。具有讽刺意味的是,假冒抗疟药再次成为东南亚和非洲的巨大问题——但那是以后的故事了。
1880 年,首次尝试通过国家食品和药品法——但失败了,因为公众眼中没有迫在眉睫的危机。
在厄普顿·辛克莱对芝加哥肉类加工厂的揭露性作品《丛林》中令人毛骨悚然、令人作呕的描述之后,国会在 1906 年通过了立法,禁止买卖不纯和贴错标签的食品和药品——尽管没有要求疗效。但这项立法实际上并没有牙齿,因为举证责任在于 FDA,需要证明药物的标签是虚假和欺诈性的,才能将其从市场上撤下。” 同样,也没有要求披露药物成分,因为它们被认为是商业秘密,因此得名“专利药”。听起来耳熟吗?
在消费者保护方面进展甚微,1911 年,最高法院在“美国诉约翰逊案”中裁定,1906 年的 FDA 法案确实禁止对药物的成分或身份做出虚假或误导性陈述——但仍然没有禁止谎报疗效。
直到 1938 年,在发生 107 例因“磺胺酏剂”死亡事件后,FDA 才能够要求“制造商在药物上市前证明其安全性”。这确立了临床试验的必要性。
意外后果
临床试验旨在了解药物(或器械)是否按预期发挥作用——在人体试验之前,这是未知的。这就是为什么早期阶段的试验只使用少数人,并且随着经验的积累而增加人数。有时会在过程中做出意想不到的发现。例如,米诺地尔是 Rogaine 的成分,是一位精明的临床研究人员在高血压临床试验中发现的。最初作为抗高血压药物进行研究的药物米诺地尔,意外地被发现具有刺激头发生长的副作用,从而催生了一整条针对秃顶的产品线。
同样,伟哥也是意外发现的。西地那非(通用名)正在作为治疗心绞痛的药物进行研究,因为它通过阻断一种酶——磷酸二酯酶 (PDE) 来扩张血管。虽然对心绞痛不是很有效,但发现它可以延长勃起时间,从而刺激了整个“生活方式药物”行业。幸运的是,现在发现 PDE 抑制剂对一系列重要的医疗状况都有用,从肺动脉高压到哮喘和肌肉萎缩症。
当然,并非所有意外发现都有如此美好的结果。
例如,己烯雌酚 (DES) 是一种合成雌激素,在美国 1938-1971 年间被普遍处方,以帮助预防流产。多年后才发现 DES 会导致暴露妇女的女儿患上一种罕见的阴道癌。后来,也出现了其他类型的癌症,但数量很少。
沙利度胺对发育中胚胎的悲剧性影响可能是药物研发史上最臭名昭著和最可怕的意外后果。沙利度胺于 1957 年首次上市,在德国可以非处方购买,用于治疗妊娠反应。几年后,人们才清楚地将孕早期使用沙利度胺与大量出生时肢体像海豹鳍状肢而不是肢体(海豹肢畸形)的儿童联系起来。然后,沙利度胺从市场上撤下。人们对该药物的兴趣再次引起争议,FDA 于 1998 年批准沙利度胺用于多发性骨髓瘤;目前正在探索其在其他严重疾病中的用途。
善与恶——伦理标准
1928 年,通过一次偶然的发现,亚历山大·弗莱明在一个“霉菌汁”中发现了青霉素,这种“霉菌汁”抑制了培养皿上细菌的生长。直到 1939 年,青霉素的潜在价值才被人们认识到,当时它的纯化和开发开始认真进行,作为战时努力的一部分。战争(以及国家之间更友好的竞争)往往是研究的动力,并导致了许多有用的发明。血管外科、区域麻醉和骨科,以及不太明显的免疫疗法以及疟疾和其他感染的治疗都自然而然地取得了进步。
例如,1940 年的动物研究表明,小鼠可以有效地用青霉素治疗链球菌。第一位患者于 1941 年接受了青霉素治疗,这在现在将被称为“同情用药”。不幸的是,虽然他最初对治疗有反应,但可用的药物不足,他后来死于链球菌感染。
然而,这个“概念验证”足以刺激英国和美国之间的发展和广泛合作,这是由于希望获得该药物来治疗二战中的军事伤亡。在科学研究与发展办公室 (OSRD) 的推动下,制药公司加入了这项爱国的战时努力;默克公司是第一家开发出用于临床的抗生素的公司,随后是施贵宝、辉瑞和礼来。1943 年,战争生产委员会 (WPB) 承担了增加产量以满足军队需求的责任。国家研究委员会主席切斯特·基弗博士担任着令人吃力不讨好的职位,即定量配给向军队以外的人员提供的有限的青霉素库存。虽然不是通过正式的临床试验,但基弗博士也收集了关于平民反应的数据。今天,当患者在试验方案之外接受实验性药物时,也会遵循相同的流程。
截至 1945 年 3 月 15 日,青霉素的定量配给停止了,因为有充足的供应可以满足军事和公众的需求。不幸的是,“奇迹药物”被浪费了,现在它与许多其他抗生素一样,用途有限——细菌的进化变得更成功地产生了耐药性,而药物开发却未能跟上步伐。我们许多人担心我们正在进入后抗生素时代——美国传染病学会自 2004 年开始的“坏细菌,无药物”运动以来,一直试图呼吁人们关注这个严重的问题。在似曾相识的时刻,澳大利亚新闻刚刚报道说,国际短缺再次导致那里不得不定量配给青霉素。
规范化、标准化的临床试验正式开始于对二战暴行滥用的回应,世界共识确立了人体研究的伦理要求。
大多数药物试验都受到严格监管,参与是安全的。那些不安全的试验会成为头条新闻,因为它们能吸引眼球。丽贝卡·斯克鲁特的精彩、引人入胜的故事《永生的海瑞塔·拉克斯》是医学研究误入歧途以及我们对故事阴暗面着迷的极好例子。但是,如果没有临床试验,我们任何人都不会有任何处方药可用。
正如我们所见,药物研发的历史有时是曲折的。临床研究既不完美,也并非没有一定程度的风险,但这些风险可以降到最低,而且现在比过去任何时候都有更多的保障措施。近几十年来,药物、医疗器械、疫苗和新型疗法的开发取得了巨大进步。每一种都经过了类似的广泛测试过程,然后才被批准供公众使用。但是,由于这些早期阶段的测试最多只涉及几千名志愿者,因此新药被数百万人服用后,市场上出现意想不到的结果是不可避免和无法避免的。
在未来的文章中,我将更详细地解释临床试验是如何进行的,以及如果您曾经考虑自愿参加,您应该问哪些问题。我还将介绍药物研发中的障碍、与妇女和少数族裔相关的问题,以及伦理问题,包括我们在药物研发中的优先事项。也非常欢迎您提出您可能想讨论的建议。
这篇文章改编自我的书《进行临床研究:医生、护士、研究协调员和研究人员的实用指南》。