编者注(2021年10月8日):David Julius,本文2006年的作者之一,是2021年诺贝尔生理学或医学奖的共同获得者,以表彰其在人体感知温度和触觉方面的发现。
搏动、瘙痒、酸痛、刺痛、灼痛、重击、穿刺。疼痛有各种令人不快的类型。但所有疼痛都有一个共同点:承受疼痛的人都希望它停止。
然而,当今最广泛使用的镇痛药本质上是几个世纪以来使用的民间疗法:吗啡和其他阿片类药物来自罂粟,阿司匹林来自柳树皮。虽然这些治疗方法可以缓解疼痛,但每种方法都有其局限性。阿司匹林和其他非甾体抗炎药 (NSAIDs),如布洛芬,无法缓解最严重的疼痛。即使是通常是最强效的药物阿片类药物,也并非对所有人都有效。此外,它们可能有严重的副作用,患者往往会对它们产生耐受性,需要不断增加剂量才能获得任何缓解。
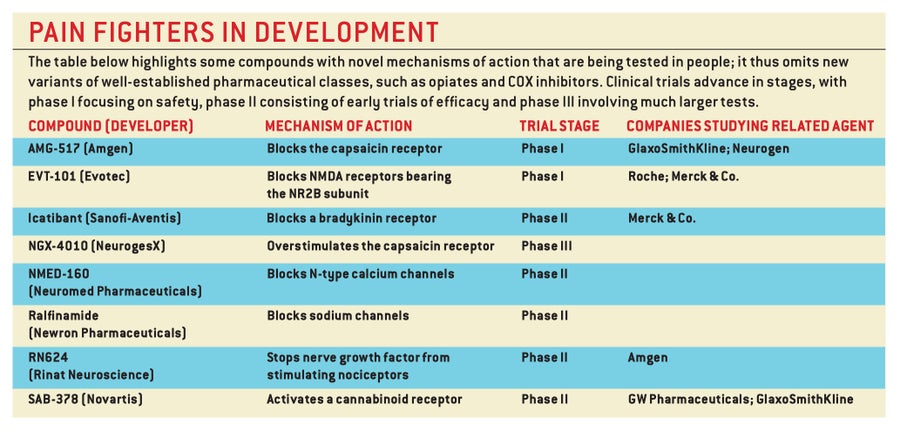
在过去的20年中,神经生物学家对细胞回路和传递疼痛信号的特殊分子有了深入的了解。今天,这些知识正被用于设计新的策略,以更好地管理疼痛并减少副作用。事实上,现在正在研究的方法比我们能讨论的还要多。
火焰粒子
在17世纪,法国哲学家勒内·笛卡尔列举了一种理论来解释人们如何感知疼痛。他认为,捏、打或戳本质上是拉扯神经绳索,然后在大脑中敲响疼痛警报铃。想象一下,例如,脚被烧伤。“快速移动的火焰粒子,”笛卡尔认为,会产生一种扰动,“沿着神经丝传递,直到到达大脑。”
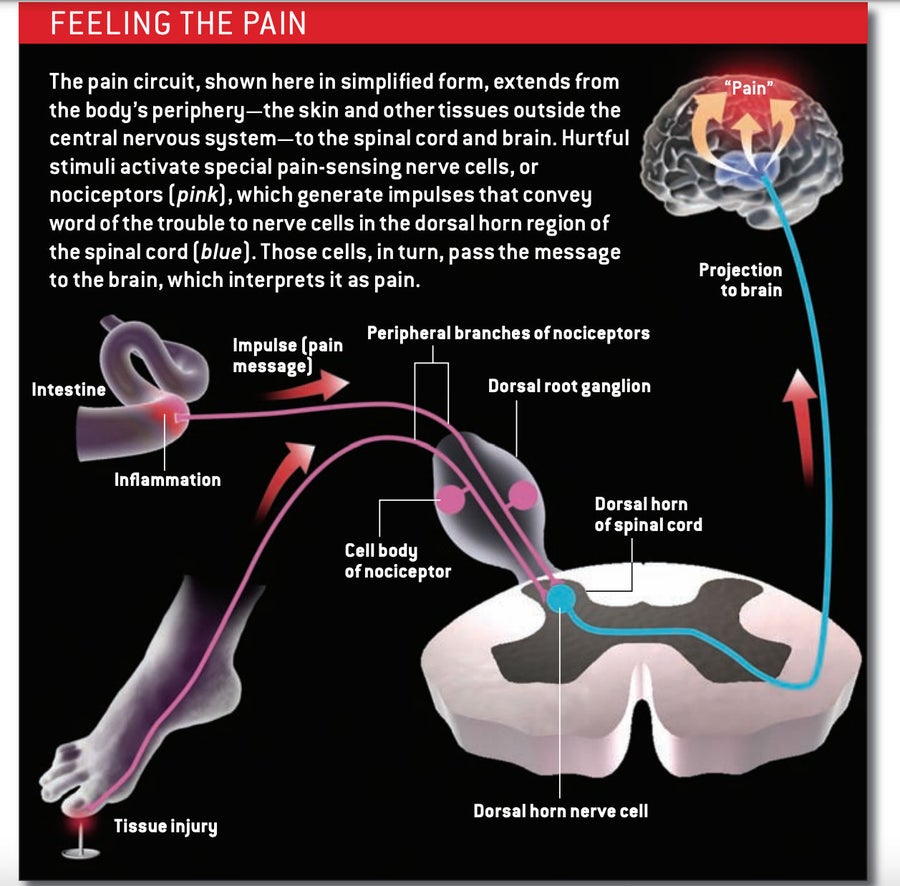
笛卡尔的观点并没有太离谱。疼痛通常始于外周:在皮肤、内脏或中枢神经系统 (CNS) 以外的任何其他部位——即大脑和脊髓之外。 碰到脚趾或靠在热炉子上会激活称为伤害感受器的神经元(神经细胞),这些神经元专门响应有害刺激,例如极端温度或机械压力,或响应损伤或炎症而产生的化学物质。
伤害感受器有两条臂:一条感觉检测分支延伸到外周,在那里支配小片组织;另一条分支延伸到脊髓[见下方方框]。神经元的细胞体位于脊柱外部的结构中,位于两条臂之间。当外周分支上的特殊检测分子在皮肤或器官中遇到有害物质时,它们会触发一个冲动,该冲动沿着线路向上,沿着中央分支到达脊髓中称为背角的区域。在那里,伤害感受器释放称为神经递质的信号分子,这些分子激活背角中的神经元,促使它们将警报信息传递到大脑。虽然伤害感受器通常被称为疼痛感应神经元,但它们仅仅表明可能存在有害刺激; 是大脑将信号解释为疼痛,并促使我们说“哎哟”。
并非所有疼痛都令人担忧。例如,伴随轻微组织损伤(如扭伤或擦伤)的急性疼痛具有保护作用:它鼓励生物体避免进一步损伤。这种疼痛往往是暂时的,并且会随着时间的推移而消退。
最困扰患者和医生的是那些不会消失且难以治疗的疼痛。在许多情况下,问题出现的原因是引发不适的损伤或炎症持续存在。关节炎的疼痛是持续炎症的结果,而侵袭性癌症可能伴随的剧痛很大程度上源于组织损伤和炎症。
在其他情况下,持续性疼痛是神经性疼痛,是神经细胞本身受损造成的。当CNS中的神经元因多发性硬化症、中风或脊髓损伤等而持续受损时,可能会发生神经性疼痛。或者,它可能源于外周神经元的损伤。截肢者忍受不再存在的肢体的疼痛(幻肢痛)以及疱疹感染消退多年后皮肤仍有灼痛感的人(带状疱疹后神经痛)都患有神经性疼痛。当这种疼痛持续存在时,它不是某些持续性损伤或其他疾病的症状; 它本身就是神经系统的疾病,需要疼痛专家的关注。
无休止的疼痛
那些患有难以控制的疼痛的人的一个主要共同点是对刺激异常敏感。这种敏感性可能表现为痛觉过敏(对通常的疼痛输入的过度反应)或异痛症(对通常无害的输入的疼痛反应)。在受异痛症影响的人中,即使是衣服对皮肤的轻柔压力或弯曲关节也可能变得难以忍受。
生物学家现在了解到,这种增强的敏感性——或致敏作用——源于神经细胞中的分子或结构变化。例如,在外周,促进炎症的分子可能会导致检测有害刺激的伤害感受器对这些输入变得过度反应。炎症分子甚至可能导致伤害感受器在没有任何环境输入的情况下开始产生信号。
致敏作用也可能源于导致疼痛传递通路过度活跃的CNS变化。这些变化可能会持续很长时间,可能包括显示对伤害感受器释放的神经递质做出反应的受体数量增加,甚至可能包括连接的重新布线和通常抑制疼痛信号传导的神经细胞的丧失。当CNS参与时,这种情况称为中枢敏化。
无论具体是什么过程导致,事实证明,持续性疼痛都可能导致致敏作用,从而加剧和延长不适。因此,许多研究人员在寻找新的镇痛药时,首先想到的是改善痛觉过敏和异痛症。与此同时,患者需要认识到,不应默默忍受持续性疼痛;它需要积极治疗以防止进一步致敏。
从源头开始
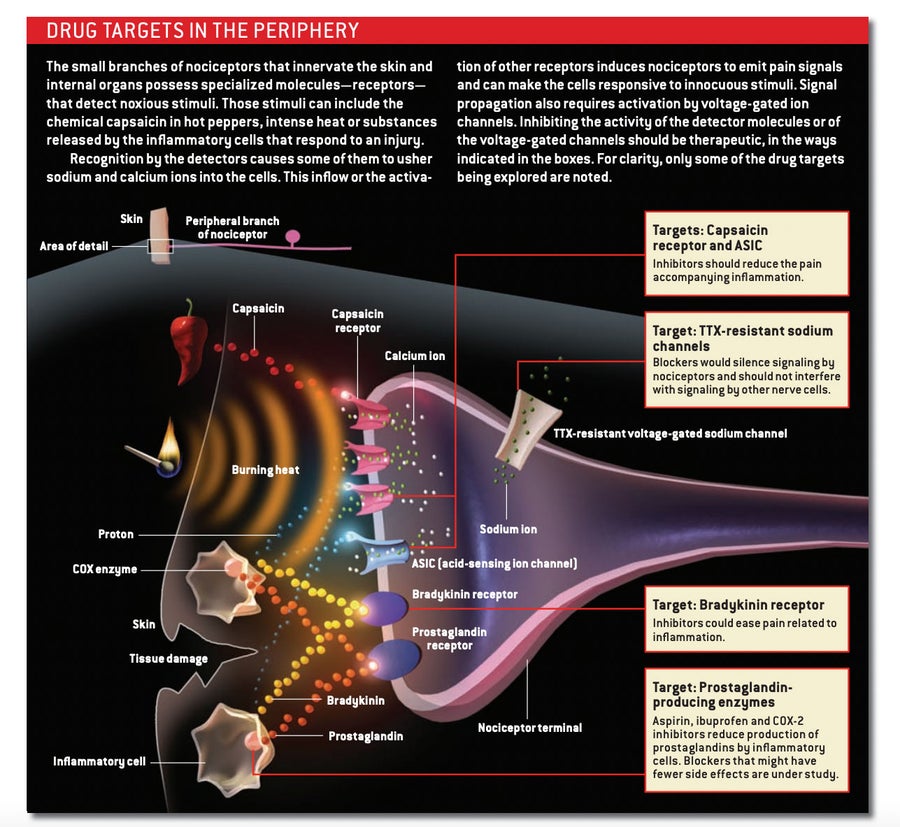
在寻找新的镇痛药的过程中,许多努力都集中在有害信号通常起源的地方:外周。伤害感受器用于检测有害刺激的某些特殊分子很少在身体的其他部位出现。阻断这些分子大概可以关闭疼痛信号传导,而不会扰乱其他生理过程,从而不会引起不必要的副作用。
图片来源:AMADEO BACHAR
当今最流行的疗法——阿司匹林和其他NSAIDs——主要在外周发挥作用。当组织受伤时,该区域的各种细胞会泵出称为前列腺素的化学物质,这些化学物质作用于伤害感受器的疼痛感应分支,降低其激活阈值。阿司匹林和NSAIDs抑制细胞用于产生诱发疼痛的前列腺素的酶家族(环氧合酶)的活性。 这些非处方化合物可以缓解日常的疼痛。但它们也抑制身体其他部位的前列腺素产生,通常会导致胃痛、腹泻和溃疡等副作用。这些问题可能会阻止药物的长期使用并限制可以给药的剂量。
为了减少胃肠道后果,制药公司开发了一系列靶向酶环氧合酶-2 (COX-2) 的药物。由于COX-2通常不在胃或肠道中发挥作用,因此阻断其活性不应引起与传统NSAIDs相同的破坏。它们是否真的对胃温和尚待确定。与此同时,这些药物也有自身的问题。罗非昔布 (Vioxx) 是一种COX-2抑制剂,曾被处方用于缓解关节炎疼痛,但由于发现它会增加心脏病发作和中风的风险,因此已从市场上撤下。其他COX-2抑制剂也正在接受不良影响的审查。
送入辣椒酱
几乎只存在于伤害感受器上的靶点的发现为开发选择性缓解疼痛的药物提供了机会。特别吸引人的靶点是辣椒素受体。这种离子通道存在于许多伤害感受器的膜中,不仅对辣椒素(辣椒中的刺激性成分)做出反应,而且对令人痛苦的热量和质子(使物质呈酸性的氢离子)做出反应;质子在发炎的组织中异常丰富。在这些化学物质或高于 43 摄氏度的温度存在下,该通道允许钠离子和钙离子涌入伤害感受器,刺激其产生信号,转化为由热、炎症或辛辣食物引起的灼烧感。
因此,抑制辣椒素受体的物质应能减轻炎症性疼痛。事实上,在实验动物中,这种“拮抗剂”已经能够缓解由转移并损害骨组织的肿瘤周围的酸性环境引起的非常严重的疼痛。今天,许多制药公司正在竞相开发辣椒素受体拮抗剂。
操纵受体的可能性不止于此。具有讽刺意味的是,在某些情况下,有目的地刺激辣椒素受体可以减轻疼痛。含有辣椒素的外用霜剂被处方用于缓解术后伤口愈合或由艾滋病毒感染、疱疹发作和糖尿病引起的神经损伤可能伴随的瘙痒、刺痛和刺痛感。尽管长期小剂量最终可能会使受体对通常的刺激不那么敏感,或者可能导致伤害感受器释放的神经递质耗尽,但这些软膏的确切作用机制尚不清楚。
阻断其他通道
在伤害感受器的外周末梢发现的另一种分子也引起了人们对药物靶点的兴趣。 所有神经元都拥有钠通道,这些通道响应神经细胞膜两侧电压的变化而打开,产生从一个神经元向另一个神经元传递信息的冲动。 目前,暂时灭活这种电压门控钠通道的局部麻醉剂用于治疗各种不同的疼痛,特别是那些因牙医就诊引起的疼痛。 然而,问题在于这些麻醉剂必须应用于不适部位:在整个神经系统中禁用钠通道可能是致命的。
然而,疼痛感应神经元拥有一种电压门控钠通道亚类,称为TTX耐受型,这种通道在中枢神经系统中不存在。 因此,研究人员希望能够阻断这种亚类的药物可以全身给药(全身),而不会产生不良影响。 此外,研究表明,此类药物很可能能够抑制受损外周神经的不适当的过度活跃,从而可能缓解某些神经性疼痛。 不幸的是,制药行业迄今未能成功开发出此类通道的选择性抑制剂,部分原因是它们与广泛分布于整个神经系统中的TTX敏感型钠通道非常相似。
图片来源:AMADEO BACHAR
然而,或许可以使用一种称为RNA干扰的新技术选择性地移除这些通道。 该方法依赖于将称为小AMADEO BACHAR干扰RNA (siRNA) 的微小分子引入生物体。 这些siRNA通过诱导指导蛋白质合成的分子(信使RNA)的降解来阻止不需要的蛋白质的产生。 该技术正在人体中研究用于某些视网膜疾病,但将RNA干扰转化为疼痛的药理学干预将具有挑战性。 与基因疗法一样,病毒很可能需要传递siRNA,而这方面引起了安全担忧。 时间会证明该方法是否可以作为疼痛疗法切实可行,但它仍然是一种令人兴奋的可能性。
假设制药公司确实开发出了一种所谓的“魔弹”镇痛药:一种能够特异性且有效地消除伤害感受器上的一种疼痛转导分子活性的化合物。 这种干预措施能否缓解顽固性疼痛? 也许不能,因为关闭通往疼痛通路的一个入口可能是不够的。
例如,想象一下一种药物可以敲除缓激肽受体——缓激肽是一种小蛋白质或肽,在外周炎症期间产生。 缓激肽有力地刺激伤害感受器,而阻断其受体的拮抗剂肯定会阻止这些受体激活伤害感受器。 但它不会阻止神经元识别和响应由损伤或炎症产生的其他诱发疼痛的分子——例如质子、前列腺素和一种称为神经生长因子的蛋白质。 同样,仅削弱辣椒素受体可能无法减轻所有质子介导的疼痛,因为在某些情况下,质子会激活伤害感受器上称为ASIC(酸敏感离子通道)的单独的检测器群。
专注于脊髓
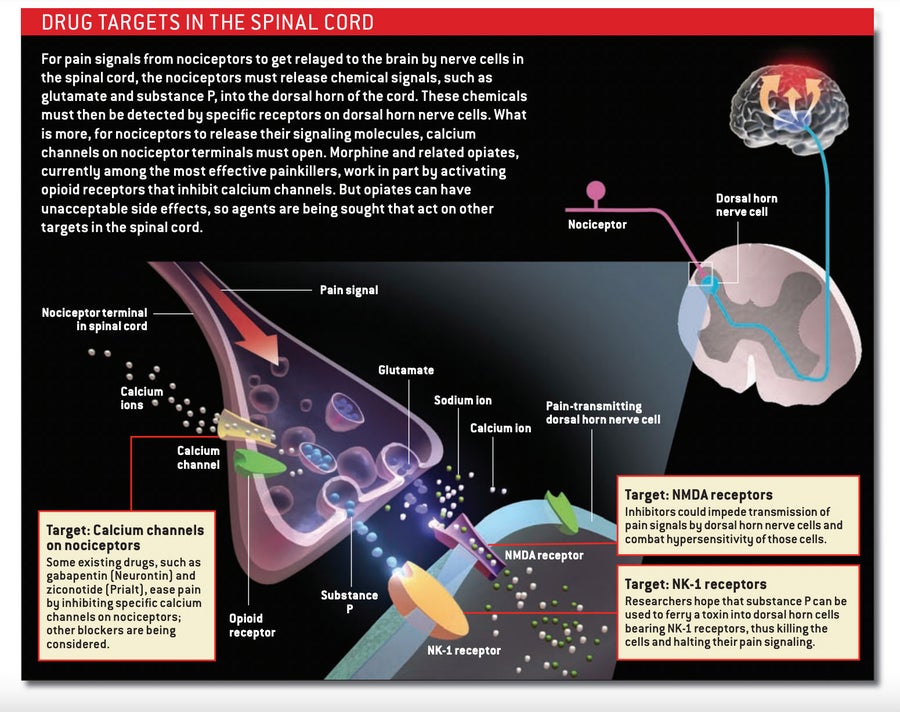
解决这种冗余问题的一种方法是施用靶向多种疼痛机制的抑制分子混合物。 然而,另一种方法是靶向作用更集中的分子,阻止所有伤害感受器(无论最初激活它们的刺激是什么)将其疼痛信号传递到脊髓神经元的能力。
吗啡和其他阿片类药物采用后一种策略,它们与到达脊髓的伤害感受器末梢上的阿片受体结合。 在激活这些受体的过程中,阿片类药物阻止神经递质释放,从而阻断疼痛信息向脊髓神经元的传递。 它们还使背角神经元不太可能对疼痛信号做出反应。 由于这些药物在脊髓中起作用,因此理论上它们应该能够治疗所有类型的疼痛,尽管它们往往对与炎症相关的疼痛最有效。
不幸的是,阿片受体存在于全身的神经元上,包括大脑和胃肠系统。 这种普遍存在解释了为什么吗啡及其同类药物会产生广泛的不良副作用,包括严重的便秘和呼吸抑制。 这些问题可能会限制患者可以安全服用的药物量或医生会开的药物量。 许多医生不愿处方阿片类药物,担心患者会上瘾。 然而,成瘾在仅因疼痛而服用阿片类药物的人中并不常见。 为了部分避免某些不良影响,阿片类药物通常直接输送到脊髓周围充满液体的空间(鞘内)。 这些药物也可以通过注射(用于术后疼痛)或通过留置泵(用于慢性疼痛)给药。
阿片类药物的替代品也可用。 干扰钙通道的药物可以阻止神经递质从脊髓中的伤害感受器末梢释放。 加巴喷丁 (Neurontin) 是一种抗惊厥药,据信它通过与某些钙通道的特定亚基相互作用来缓解某些形式的疼痛。 一种相对较新的药物齐考诺肽 (Prialt)——源自太平洋芋螺的毒液——抑制一种不同类型的钙通道,称为N型。
与阿片受体一样,N型钙通道也存在于整个神经系统中。 如果齐考诺肽全身给药,血压会急剧下降。 因此,该化合物是鞘内给药的。 尽管毒素可以阻断疼痛,但其在中枢神经系统内的作用仍然可能产生令人不快的副作用,包括头晕、恶心、头痛和意识模糊。 因此,齐考诺肽主要用于晚期癌症患者,他们无法通过其他方式获得缓解。
最近,作用于大麻素受体(介导大麻作用的受体)的药物已在临床试验中取得进展。 这些药物似乎通过多种方式缓解疼痛,包括干扰伤害感受器及其靶细胞之间的信号传递,以及降低炎症细胞的活性。
关闭舱口
一些研究人员正专注于阻止脊髓神经元对伤害感受器释放的神经递质做出反应——特别是对氨基酸谷氨酸(疼痛信息的主要载体)做出反应。 谷氨酸激活脊髓背角的各种受体。 其中,NMDA类受体参与中枢敏化,这使其成为新镇痛药的合理靶点。
图片来源:AMADEO BACHAR
身体中的每个神经元都拥有某种类型的NMDA受体。 因此,一次性抑制所有类型将引发灾难性的影响,包括记忆丧失、癫痫发作和瘫痪。 为了避免此类反应,研究人员正试图通过作用于主要在背角中发现的版本来削弱受体。 与含有称为NR2B亚基的形式结合的化合物在动物研究中已产生令人鼓舞的结果。 例如,直接向脊髓液中输送NR2B抑制剂的小鼠比未治疗的动物对疼痛的敏感性更低。 该药物还逆转了外周神经损伤小鼠的异痛症。
许多伤害感受器还会释放肽神经递质,如P物质和降钙素基因相关肽 (CGRP)。 这些肽通过作用于离散受体来激活脊髓中的疼痛传递神经元,因此预期阻断与这些受体相互作用的药物会有所帮助。 遗憾的是,选择性阻断P物质使用的受体——神经激肽-1或NK-1受体——在疼痛的临床试验中失败了,这可能是因为单独阻断该受体是不够的。 抑制脊髓中的CGRP活性是否会关闭疼痛尚不清楚,尽管制药行业正在开发旨在通过干扰CGRP释放到大脑表面的血管上来缓解偏头痛痛苦的拮抗剂。
杀死信使?
如果所有调节疼痛信号传导的尝试都失败了,可以考虑杀死信使。 然而,切断伤害感受神经通常会适得其反,因为正如我们已经指出的,神经损伤会促进更顽固、持久性疼痛的发生。 切断脊髓中将信息传递到大脑的通路(脊髓切断术)曾经很常见,但现在仅保留给对所有疼痛治疗均无反应的晚期癌症患者。 这种最后一种手术的问题是,外科医生无法选择性地切断“疼痛”通路。
一种可能的解决方案,由于其在动物身上的成功而现在引起了相当大的关注,是一种分子疗法,它可以去除脊髓神经元的一个子集,这些神经元接收来自伤害感受器的输入。 这种细胞杀伤疗法将毒素皂草素与P物质结合。 结合物中的P物质与NK-1受体结合,导致整个化合物的内化,之后皂草素被释放以杀死神经元。 由于结合物只能进入具有NK-1受体的细胞,因此研究人员希望副作用将受到限制。
来源:FRANZ F. HEFTI Rinat Neuroscience Corporation
然而,脊髓神经元的消融应被视为最后的手段:中枢神经系统中的神经元不会再生,因此由此产生的变化——无论是好是坏——都将是永久性的。 同样的永久性在外周神经系统中不成立,在周围神经系统中,切断的纤维可以再生。 理想情况下,减少伤害感受器的信号检测分支的疗法(例如高剂量的辣椒素)将停止疼痛,但允许分支最终再生,从而恢复之前支配组织片的正常疼痛检测。
靶向神经元可能不是克服疼痛的唯一方法。 研究表明,神经胶质细胞(滋养中枢神经系统中神经元的细胞)在响应外周神经损伤时会发挥作用。 神经胶质细胞迁移到与受损神经相关的背角区域。 然后,神经胶质细胞释放大量化学物质,这些化学物质促使伤害感受器末梢在脊髓中释放神经递质,从而使疼痛信号持续存在。 其中一些物质,包括生长因子和称为细胞因子的分子,也会使背角神经元过度兴奋,而阻断这种过度活跃的药物应有助于削弱过度敏感性。 各个研究小组正在努力识别——并找到抑制方法——在神经受损时募集和激活神经胶质细胞的分子。
有趣的是,前列腺素是脊髓中激活的神经胶质细胞释放的关键物质之一。 它们通过阻断背角神经元上的甘氨酸受体来增强疼痛。 甘氨酸是一种抑制性神经递质,通常会使这些神经元安静下来。 因此,NSAIDs可能不仅通过干扰外周前列腺素的产生(熟悉的方式)发挥作用,而且还通过抑制神经胶质细胞中的COX酶发挥作用。 在这种情况下,将COX抑制剂直接输送到脊髓液中可能会最大限度地减少全身输送引起的副作用。 一种增强甘氨酸受体活性的药物也有助于抑制疼痛信息向大脑的传递。
感知问题
在本文中,我们讨论了治疗疼痛的实验方法的一个子集,所有这些方法都在动物研究中显示出前景。 那些引起最大兴奋的方法在保持正常感觉完好无损的同时,减少了难以治疗的炎症性和神经性疼痛的特征性增强的敏感性,并具有可接受的副作用特征。 但这些疗法会帮助患者吗? 它们对所有类型的疼痛都有效吗? 这些问题仍未得到解答。
一种值得进一步探索的方法是使用行为、非药物疗法来治疗顽固性疼痛——特别是那些与纤维肌痛和肠易激综合征等疾病相关的疼痛,对于这些疾病,没有人最终确定器质性病因。 大约十年前,麦吉尔大学的研究人员证明,催眠可以改变大脑活动以及一个人对疼痛的感知。 科学家对志愿者进行催眠,并向他们暗示,他们将手浸入的热水浴比实际情况更令人不快或更令人愉快。
研究人员使用正电子发射断层扫描监测大脑活动,发现躯体感觉皮层(对物理刺激的强度做出反应)在两种情况下都同样活跃。 但第二个大脑区域——扣带回皮层——在受试者认为刺激更令人不快时更活跃,这表明催眠改变了这些人感知感觉的方式。 通过更多地了解大脑如何调节疼痛体验,研究人员或许能够开发出更好的认知疗法来调节疼痛感知。
诗人艾米莉·狄金森经常思考痛苦。 在一部作品中,她写道:
痛苦具有空白的元素;
它无法回忆
它何时开始,或者是否有
没有痛苦的一天。
它没有未来,只有自身。
我们只能希望对疼痛感觉机制的持续研究将带来安全有效的治疗方法,从而改变疼痛的未来,使其恢复到没有疼痛的时代。