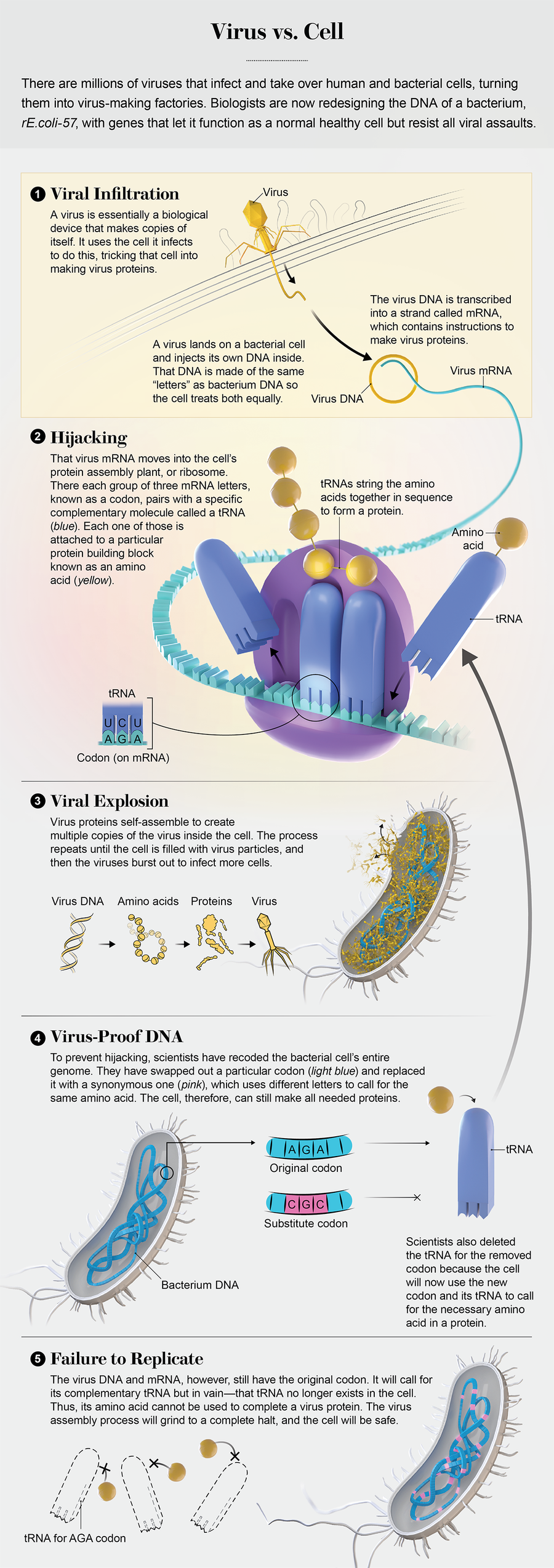
病毒像蜘蛛落在比自身大 1000 倍的气球上一样接触细胞。它有六条细腿,展开在一个形似注射器的身体下方,头部呈球状。这是一个名叫 lambda 的捕食者,它的猎物是大肠杆菌。找到受害者后,lambda 现在做了自生命首次出现以来无数万亿病毒所做的事情:它用腿抓住细胞膜,将其注射器状部分连接到孔隙并收缩,将 DNA 注射到内部。
DNA 包含制造更多病毒的指令,这几乎就是病毒的全部:一个蛋白质胶囊,里面装着构建自身更多副本的蓝图。病毒没有构建新事物的分子机器。相反,它们闯入细胞并劫持细胞设备,利用它进行复制,直到病毒数量过多,它们就会冲破细胞壁。它们可以做到这一点,因为从非洲平原上的犀牛到感染您鼻子的鼻病毒,所有生物都使用相同的编码系统,该系统基于核酸,如 DNA。将代码输入细胞,它将使用这些指令来构建蛋白质。
在受感染的细菌中,这个过程开始了。新的病毒蛋白成形。情况对 lambda 来说看起来不错。几分钟之内,细胞就会充满大量全新的病毒。当它们爆发时,每个病毒都会前往另一个细菌,旨在一次又一次地重复这个循环。
支持科学新闻报道
如果您喜欢这篇文章,请考虑通过以下方式支持我们屡获殊荣的新闻报道 订阅。通过购买订阅,您正在帮助确保有关当今塑造我们世界的发现和想法的具有影响力的故事的未来。
然后细胞机器冻结了。它根本无法读取病毒的 DNA。在病毒和细胞之间看似永恒的决斗中,这种失败从未发生过。现在这意味着 lambda 注定要失败。
它灭亡的原因是这种大肠杆菌菌株已被重新编程为使用地球上从未存在过的 DNA 操作系统,而病毒代码与之不兼容。这些差异使 lambda 像 Mac 中的 Windows 计算机病毒一样无助。攻击的其他病毒也会遭受同样的命运。制造这种细菌及其新代码的人们相信,该功能将使其对所有病毒免疫。他们称之为rE.coli-57。他们对此有宏伟的计划。
rE.coli-57 正在哈佛医学院的一个实验室中由一位名叫尼莉·奥斯特罗夫的年轻生物学家领导的团队构建。在过去的五年里,奥斯特罗夫痴迷于细菌基因重建的每一个细节,在潮湿实验室的荧光灯下投入了艰苦的工作时间。这是历史上最精细的基因编辑项目,也是 2016 年科学杂志一篇里程碑式论文的主题,该论文确定了使细胞具有抗病毒性所需的 148,955 个 DNA 变化。奥斯特罗夫的团队已经完成了其中 63%,她和她的同事报告说,并且这个“野兽”表现良好。
三年后,重建的细胞几乎准备就绪。不久之后,刚刚设想的场景将发生,不仅有一个,而是数百个病毒在一个培养皿中。如果 rE.coli-57 存活下来,它可能会永远改变病毒与其猎物(包括我们)之间的关系。
病毒非常丰富,每平方米的地球表面都有 8 亿个病毒覆盖。它们用疾病困扰我们,但也折磨着使用细胞制造从酸奶到药品等产品的行业。生物技术巨头健赞(现为赛诺菲的一部分)使用细菌制造药物分子,在 2009 年其位于马萨诸塞州奥尔斯顿的工厂发生病毒感染破坏其生产线,引发关键药物短缺后,市值损失了一半。病毒也是乳制品行业中代价高昂的祸害,该行业使用细菌发酵奶酪和酸奶——当细菌受到病毒污染时,这些产品必须被倾倒。一种抗病毒细菌可能是一种价值数十亿美元的“虫子”。
这种细胞还可以开辟一个设计药物的新世界。“如果我们想制造精美的抗体和精美的蛋白质药物,我们需要将不同的化学物质融入其中,”奥斯特罗夫说。“这将是制药公司的游戏规则改变者。”所有天然蛋白质都由相同的 20 种氨基酸构成,但 rE.coli-57 的改变后的操作系统将允许它使用外来氨基酸构建新的蛋白质,就像新的乐高积木扩展了基本入门套装可以构建的东西一样。设计蛋白质可以以极高的精度靶向艾滋病或癌症等疾病。
更具争议性的是,rE.coli-57 的成功可能是使人类细胞具有抗病毒性的第一步,方法是使其 DNA 不受病毒劫持。这项成就对医学研究非常宝贵,医学研究深受实验室培养皿中用于开发和测试治疗药物的人类细胞系的病毒感染之苦。然而,怀疑论者怀疑重新编码的细胞是否会像“正常”细胞一样发挥作用,从而使它们成为不可靠的试验平台。这个想法也让那些担心这种重新编码使我们离创造具有设计 DNA 的人类更近一步的人感到担忧。(没有人参与该项目提议设计人。)仅仅重新编码一个人类实验室培养皿细胞就会非常复杂,因为人类基因组长达 32 亿个字母,比大肠杆菌大 800 倍。但 rE.coli 是至关重要且令人兴奋的第一步。
代码破解者
重新编码击败病毒入侵者的原因是它改变了细胞用来制造蛋白质的语言,蛋白质是所有生命用来完成世界上任何事情的分子。蛋白质由称为氨基酸的较小单元组成,每个氨基酸都有一个三字母 DNA 代码,由四种 DNA 碱基(A、C、G 和 T)的某种组合构成。例如,TGG 表示色氨酸,CAA 表示谷氨酰胺。这些三字母代码称为密码子,每个基因都只是它们的线性序列。
蛋白质的制造发生在序列被发送到细胞工厂核糖体时,在那里密码子与称为转移 RNA (tRNA) 的分子配对。每个 tRNA 的一端与特定密码子结合,另一端与一种且仅一种氨基酸结合。随着密码子序列在蛋白质组装线上移动,tRNA 将氨基酸串在一起,直到蛋白质完成。
但是这个系统中有一个重要的特性:它有很多冗余。有 64 个密码子,因为 A、C、G 和 T 的三字母组合有 64 个。但只有 20 种氨基酸。这意味着大多数氨基酸都有多个代码。例如,AGG 代表精氨酸,CGA 也代表精氨酸。有些氨基酸有六个密码子。
早在 2004 年,哈佛大学遗传学家、奥斯特罗夫的老板乔治·丘奇就开始怀疑所有这些密码子是否绝对必要。如果将大肠杆菌基因组中的每个 AGG 都更改为 CGA 会怎样?由于两者都编码精氨酸,细菌仍然会构建其所有正常蛋白质。但是——这是一个关键点——如果与 AGG 配对的 tRNA 也从细胞中消除,那么 AGG 密码子将成为蛋白质构建过程中的死胡同。
当丘奇思考去除某些 tRNA 的影响时,他有了一个顿悟。“我意识到这将使细胞对所有病毒都具有抵抗力,”他说,“这将是一个潜在的巨大好处。” 诸如 lambda 之类的病毒通过让细胞读取病毒基因并使用这些序列构建蛋白质来繁殖。但是,如果从细胞中删除 AGG 的 tRNA,那么每个包含 AGG 密码子的病毒基因都会卡住,等待不再存在的 tRNA,并且不会完成任何病毒蛋白。
病毒进化速度极快;丘奇怀疑它们会迅速绕过单个消失的 tRNA。但是,如果消除足够的密码子和 tRNA,病毒几乎不可能自发地找到正确的突变组合来使用修改后的代码。大肠杆菌有七个相对罕见的密码子。它们出现在其所有 3,548 个基因中,平均每个基因出现 17 次。如果消除所有相应的 tRNA,病毒将需要开发大约 60,000 个新序列,每个序列都要求在完全正确的位置使用正确的替代密码子。这根本不可能发生。
2004 年,这种情况只是一种空想。在一个生物体中改变单个基因已经足够困难了;编辑数千个基因以消除某些密码子的每个实例是不可能的。但是到 2014 年,技术突破使这样做刚刚处于可想象的边缘。因此,丘奇开始寻找有动力和组织能力的人来承担历史上最大的基因编辑项目。
那时,奥斯特罗夫作为博士后研究员来到他的实验室。如果说丘奇是 rE.coli-57 的架构师,那么奥斯特罗夫就成了工程师和总承包商。奥斯特罗夫有很多分子构建经验。她在以色列长大,就读于特拉维夫大学,在那里她通过添加几个与金属颗粒结合的氨基酸来修饰蛋白质。当几个这些修饰的蛋白质结合在一起时,它们形成了一个可以导电的纳米线。“那太棒了,”奥斯特罗夫回忆道。“我想,哇,我们可以利用生物学来制造有用的东西。” 后来,在哥伦比亚大学,她通过工程改造面包酵母以在检测到致病微生物时产生红色色素获得了博士学位;该项目因其在霍乱检测中的应用而获得了比尔及梅琳达·盖茨基金会的大挑战探索奖。
这是一份令人印象深刻的简历,但丘奇的项目难度呈指数级增长。要消除的七个密码子在大肠杆菌基因组中出现了 62,214 次。全部重新编码需要对 DNA 进行 148,955 次更改。关于快速简便的基因编辑有很多头条新闻,但没有基因编辑工具能够进行接近那么多更改。
然而,DNA 合成的突破指向了另一种解决方案:从头开始构建重新编码的大肠杆菌基因组。DNA 可以通过生物化学方法在特殊的 DNA 打印机中生产,DNA 打印机的工作原理类似于喷墨打印机喷射 A、C、G 和 T。今天的 DNA 合成公司可以可靠地制造长达约 4,000 个字母的 DNA 片段。
图片来源:坎贝尔医学插画
大约在 2015 年,奥斯特罗夫的团队从数据库下载了标准大肠杆菌基因组(一长串四百万个字母),并将其放在计算机上。然后研究人员浏览了整个序列,将所有 62,214 个罕见密码子的实例更改为同义密码子。(为了安全起见,他们还改变了基因,使细菌依赖于营养液中提供的合成氨基酸。这种合成分子在自然界中不存在,因此如果细菌逃出实验室,就会死亡。)结果是新的 rE.coli-57 基因组在计算机屏幕上滚动。然后,科学家们将其四百万个字母分成 4,000 个字母的片段,片段末端重叠,并将文件发送到 DNA 合成店。“我们在计算机上切割它,”奥斯特罗夫说,“就像 Word 文档一样。” 该公司打印了 DNA 并通过联邦快递寄回。该团队将这些 4,000 个字母的片段组装成 87 个大的片段,每个片段 50,000 个字母,大约 40 个基因。
当然,这些片段只是 DNA,而 DNA 只是代码。需要一个细胞来将代码变为现实,没有人知道如何完全从头开始构建一个细胞。相反,奥斯特罗夫采取了分段式方法。她从正常大肠杆菌菌落开始,并缓慢地用重新编码的片段逐个替换其基因组的每一部分,每次移植后都进行测试,以查看患者是否存活。
重建细胞
在丘奇实验室长长的黑色工作台上,在离心机、涡旋混合器、移液器架和培养皿堆之间,奥斯特罗夫的团队在宿舍冰箱大小的培养箱中培养了 87 个正常大肠杆菌菌落,将不同的 50,000 个字母的重新编码片段插入到微生物群中,然后等待观察它们是否会存活。她没有抱太大希望。也许进化选择其密码子有其自身的原因,而这些原因逃脱了人类的理解。
令人惊讶的是,大多数菌落都表现良好。只有 20 个修订后的片段阻止了微生物的生长。但 20 个片段还是太多了。为了使 rE.coli-57 具有抗病毒性,所有重新编码的部分都必须工作。“首先,我们试图缩小范围,确定哪个特定基因不起作用,”奥斯特罗夫说。“我们将 40 个基因的片段分解为两个 20 个基因的版本并进行了测试。然后我们缩小范围到可能存在问题的四个基因。然后是一个基因。然后我们弄清楚哪个密码子可能是问题所在。”
事实证明,大多数问题来自 DNA 打印错误。换句话说,奥斯特罗夫团队收到的 DNA 序列与他们订购的序列并不完全相同——直到最近,这在 DNA 合成中还是一个常见问题。奥斯特罗夫回到公司,获得了新的无错误序列。在更换不良 DNA 后,超过 99% 的重新设计的基因都起作用了。看起来,重新编码并不是一个疯狂的想法。
但是,还有少数剩余问题似乎是蛋白质或 DNA 功能的真正问题,而不是打印机上的质量控制。奥斯特罗夫必须弄清楚进化知道而她不知道的东西。为什么改变为编码完全相同氨基酸的同义密码子会杀死或损害生物体?
排除这些点的故障就像在没有地图的荒野中开辟道路。例如,重新编码的 21 区段细菌的繁殖速度慢得像爬行一样。为什么?因为没有关于这些重新编码的 DNA 片段的科学文献来指导奥斯特罗夫——她的团队是第一个重塑它们的团队——她仔细分析了该区段中所有基因的性能,将它们的产品与正常细菌中的产品进行了比较。她发现五个相连的基因是完整的,但由于某种原因,它们没有任何作用。

生物学家尼莉·奥斯特罗夫和她在哈佛大学的同事创造了 rE.coli-57,这是一种原本正常的大肠杆菌,在其基因组中进行了近 150,000 次 DNA 更改,旨在使其具有抗病毒性。图片来源:斯蒂芬·史蒂文斯
事实证明,这是一个与基因等效于开关的问题。基因前面是称为启动子的 DNA 序列,启动子控制基因是否活跃。在更高级的生命形式中,启动子和基因被清晰地划分,具有明显的起点和终点,但有时细菌基因会重叠;一个基因末端的 DNA 序列实际上兼作下一个基因的开头。奥斯特罗夫发现,基因 yceD 中的 DNA 序列兼作其后五个基因的启动子(开关)。通过重新编码 yceD,她不小心关闭了它们。她在 yceD 上更改了三个密码子,使其 DNA 更接近已知强启动子的设计。这五个基因的输出激增,细菌开始正常繁殖。
奥斯特罗夫的团队在重新编码的 44 区段中遇到了更严峻的挑战,该区段完全杀死了其菌落。研究人员将问题区域缩小到一个名为 accD 的基因,细菌使用该基因制造脂肪酸。重新编码的细胞根本没有制造任何 accD 蛋白质。奥斯特罗夫对重新编码的基因进行了设计分析,并猜测问题出在其序列的开头。在 DNA 中,A 和 T 自然结合,G 和 C 也自然结合。(在 mRNA 中,DNA 用来向蛋白质制造核糖体发送代码的分子,缩写为 U 的碱基代替了 T,它以相同的特异性与 A 结合。)如果字母以某种顺序排列——比如,很多 A,然后是很多 T——分子的末端会像不干胶带一样自身折叠,并堵塞细胞机器。在她的计算机上,奥斯特罗夫重新设计了该基因,将其 15 个重新编码的密码子中的 10 个修改为其他同义密码子,这些密码子似乎不太可能形成粘性折叠。当她将新的 DNA 片段插入细菌中时,菌落又恢复了生机。
就这样,一次又一次的故障排除练习,研究人员像机械师一样思考,同时对生物学进行修补,始终遵循工程师的设计-构建-测试循环。值得注意的是,没有出现任何交易破坏者。“到目前为止,我们还没有遇到任何不可能的点,”奥斯特罗夫说。“代码给了我们很大的回旋余地。”
抗病毒
今年,在将一个菌株的工作基因片段添加到另一个菌株的工作片段后,奥斯特罗夫将最初的 87 个菌株变成了 8 个健康菌系,每个菌系都有完全重新编码基因组的八分之一。每次科学家组合片段时,都会出现新的不兼容性,并且必须进行故障排除。但在早春,八条菌系迅速合并为四条,朝着两条前进。不久之后,将出现一种 100% 重新编码的 rE.coli-57 菌株。
一旦该菌株启动并运行,最后一步将是消除与缺失密码子相关的 tRNA。细胞会很好,因为它的基因将使用仍然存在的同义 tRNA。但是,传入的病毒应该不会好。其尚未经过重新设计的基因将具有一些密码子,这些密码子需要不再存在的 tRNA。没有 tRNA 意味着在蛋白质构建序列的该点没有氨基酸,这会停止组装。没有新的病毒蛋白,就没有病毒的新副本。病毒 DNA 仍然被困在细胞内部,孤立无援,无法复制和造成任何伤害。
奥斯特罗夫计划在一部微观版本的旧电影《冲锋飞车队续集》中测试这种情况,在该电影中,一位英雄被困在一个竞技场中,必须击败一系列攻击者。这个竞技场将是一个小型玻璃容器。生物学家会将 lambda 添加到装有健康 rE.coli-57 菌落的培养皿中。然后他们会退后一步,让生物体战斗至死。如果 rE.coli 存活下来,研究人员将添加另一种以细菌为食的病毒,然后再添加另一种。很难想象即使是最有天赋的病毒也能破解 rE.colts 经过精心修改的代码。但话又说回来,还没有病毒被迫尝试过。两个生物将进入——一个将离开。
奥斯特罗夫太谨慎了,无法确定比赛的日期,因为她还没有获得单一完全重新编码的菌株,但她相信她和她的团队即将成功。“迟早会发生,”她说。“绝对会。” 她暗示,她喜欢的巴西鸡尾酒庆祝活动可能很快就会到来。“完成时,我不会保持沉默。我会用一只手拿着凯匹林纳鸡尾酒从海滩打电话。”
仅病毒免疫力就足以让 rE.coli-57 值得庆祝,但正如奥斯特罗夫和她的同事在他们的科学论文中指出的那样,这种细菌还将提供“一种独特的底盘,具有扩展的合成功能,将广泛适用于生物技术”。换句话说,这种微生物将成为组装新型蛋白质的灵活平台。
这可能是药物开发的福音。许多癌症和免疫疗法药物是蛋白质,它们在体内会迅速分解,但用外来氨基酸重建它们可以大大延长其寿命。丘奇已经成立了一家名为 GRO Biosciences(首字母缩写词代表“基因组重新编码的生物体”)的初创公司,以设计此类疗法。
改变的生命
再过几年,重新编码的抗病毒人类细胞的愿景就会出现。这些细胞可以解决整个医学研究中使用的培养人类细胞系(例如著名的海拉细胞癌细胞)的病毒污染这一长期存在的问题。在实验室中,人类细胞系经常被用作开发新药和治疗想法的试验平台。但是,一旦病毒感染了这些细胞,就几乎不可能摆脱它们,因此实验被丢弃,科学家别无选择,只能重新开始。如果疗法能够更快地开发出来,它们将挽救生命。卓越工程生物学中心是一个全球合作项目,丘奇是创始成员,已将重新编码的人类细胞命名为其初始项目。rE.coli-57 显然将是该道路上的垫脚石。
毫不奇怪,重新设计人类细胞操作系统的想法让一些批评家感到担忧。一方面,这些细胞可能不是天然细胞的可靠模仿。尽管该中心的科学家从未提议对培养细胞系以外的细胞做任何事情,但有可能创造出一个重新编码的人类,他也可能具有抗病毒性。
哥伦比亚大学病毒学家文森特·拉卡涅洛说,这将是很糟糕的,他在他的科学博客上批评了这个想法。“多种密码子的存在是有原因的——其中之一是它们提供了对抗致命突变的缓冲,”他写道。“以这种方式重新编码人类基因组不太可能没有严重的副作用。”
该项目的科学家都没有建议鲁莽地编辑婴儿的 DNA 并观察会发生什么,就像去年在中国发生的那样。他们所说的是,对重新编码的人类细胞的行为进行仔细、透明的研究可以让我们对我们与许多最有害疾病之间的关系有全新的认识。在我们地球上的所有时间里,我们一直受困于 64 密码子系统——以及利用它的致病病毒。几年后,我们可能会知道我们是否必须接受这种情况。
奥斯特罗夫不是该中心项目的一部分——“澄清一下,我不重新编码人类细胞”——但她说,安全地在实验室培养皿中探索遗传未知很重要。“显然,进化选择它所拥有的密码子是有原因的。但我们知道还有其他可行的选择,”她说。“通过改变它们,我们可以调查会发生什么。我们将看到什么有效,什么无效,我们将更好地理解规则。” 了解这些原则可能会让我们有机会改进一些使用它们的生物体。

