编者注(2017 年 10 月 2 日):在三位美国科学家因其在生物钟方面的研究获得诺贝尔生理学或医学奖的十七年前,其中一位科学家迈克尔·W·杨在《大众科学》杂志上撰文,描述了鉴定出“分子时钟”的遗传学研究,这些“分子时钟”在整个动物王国中无处不在。如果您有兴趣了解昼夜节律的生物学——谁没有遭受过时差之苦呢?——杨在此处或许提供了关于这些研究如何展开的最引人入胜且最易理解的故事。请阅读这篇关于寻找分子时钟的清晰描述,《大众科学》早在三位研究人员前往斯德哥尔摩应对时差反应的二十年前就为您带来了这篇描述。
您必须与晚上 7:00 昏昏欲睡的冲动作斗争。下午 3 点您饥肠辘辘,但晚餐时却没有食欲。您在凌晨 4:00 醒来,无法再次入睡。许多从美国东海岸飞往加利福尼亚州的人都熟悉这种情况,这次旅行需要跨越三个小时的时差。在为期一周的商务旅行或假期中,您的身体刚刚适应新的作息时间,就又要返回家乡了,在那里您必须再次适应旧的作息时间。几乎每天,我的同事和我都会让一批果蝇经历从纽约到旧金山或返回的模拟旅行的时差。我们在实验室里有几个冰箱大小的培养箱:一个标记为纽约,另一个标记为旧金山。这些培养箱内的灯光会随着这两个城市日出日落而亮起和熄灭。(为了保持一致性,我们将两个地点的日出时间都安排在早上 6 点,日落时间都安排在下午 6 点。)两个培养箱的温度恒定,宜人的 77 华氏度。
果蝇在装在特殊托盘中的小玻璃管中进行模拟旅行,这些托盘通过窄束红外光监测它们的运动。每当果蝇进入光束时,它会在托盘中的光电晶体管上投下阴影,该光电晶体管连接到记录活动的计算机。从纽约时间到旧金山时间并不需要我们的果蝇进行五个小时的飞行:我们只需断开一个装满果蝇的托盘在一个培养箱中的连接,将其移动到另一个培养箱并插入即可。
支持科学新闻事业
如果您喜欢这篇文章,请考虑通过以下方式支持我们屡获殊荣的新闻事业 订阅。 通过购买订阅,您将有助于确保有关塑造我们当今世界的发现和想法的具有影响力的故事的未来。
我们已经使用我们的横贯大陆特快列车来识别和研究几种基因的功能,这些基因似乎是生物钟运转中的齿轮和轮子,生物钟控制着包括果蝇在内的各种生物的昼夜节律,以及小鼠和人类。 识别基因使我们能够确定它们编码的蛋白质——这些蛋白质可能成为治疗各种疾病的靶点,从睡眠障碍到季节性抑郁症。
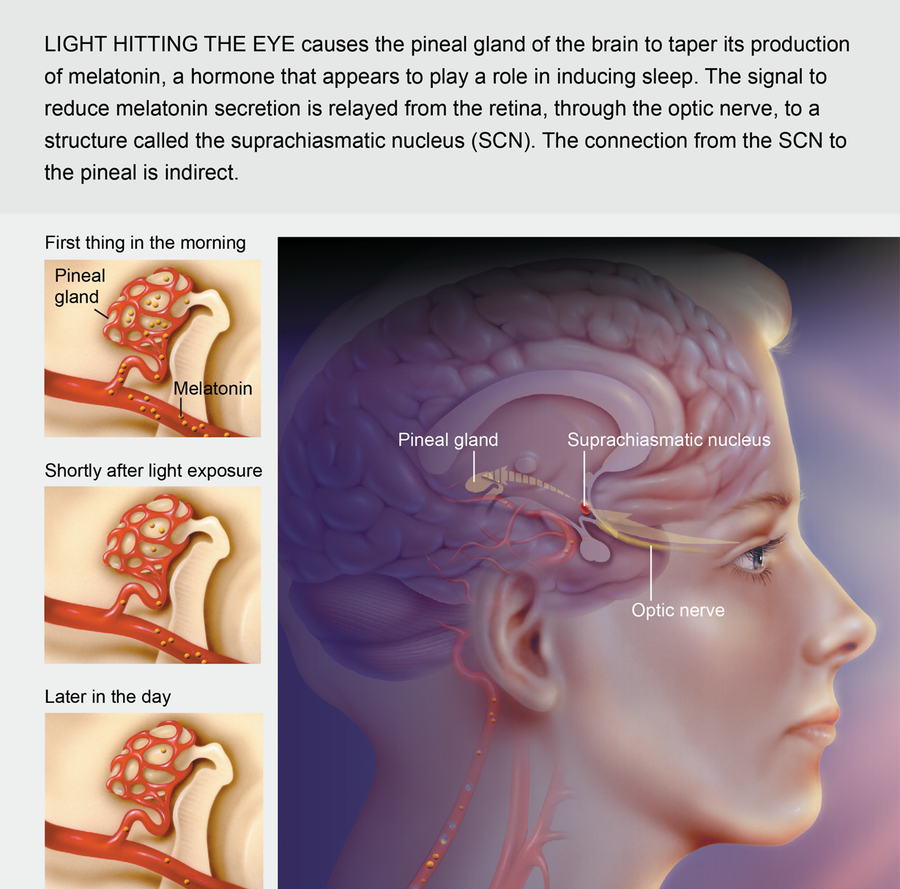
人类生物钟的主要齿轮是视交叉上核 (SCN),它是位于大脑底部称为下丘脑区域的一组神经细胞。 当每天早晨光线照射到眼睛的视网膜时,专门的神经会将信号发送到 SCN,SCN 反过来控制多种生物活性物质的生产周期。 例如,SCN 会刺激附近称为松果体的脑区。 根据来自 SCN 的指令,松果体有节奏地产生褪黑激素,即所谓的睡眠激素,现在许多保健食品商店都有药丸形式出售。 随着白天进入夜晚,松果体逐渐开始产生更多的褪黑激素。 当血液中激素水平升高时,体温会略有下降,并且入睡的倾向会增加。
来源:Cynthia Turner
人类时钟
尽管光线似乎每天都会重置生物钟,但昼夜节律或昼夜节律即使在被剥夺光线的个体中也会继续运作,这表明 SCN 的活动是天生的。 在 20 世纪 60 年代初期,当时在德国 Seewiesen 马克斯·普朗克行为生理学研究所的 Jürgen Aschoff 及其同事表明,生活在隔离掩体中的志愿者——没有自然光、时钟或其他关于时间的线索——仍然保持着大约 25 小时的正常睡眠-觉醒周期。
最近,哈佛大学的 Charles Czeisler、Richard E. Kronauer 及其同事确定,人类的昼夜节律实际上更接近 24 小时——确切地说是 24.18 小时。 科学家们研究了 24 名男性和女性(其中 11 人 20 多岁,13 人 60 多岁),他们在除了人为设置为 28 小时的微弱光暗循环之外没有时间线索的环境中生活了三个多星期,该循环为受试者提供了就寝信号。
他们测量了参与者的核心体温,这通常在夜间下降,以及褪黑激素和一种称为皮质醇的应激激素的血液浓度,皮质醇在傍晚下降。 研究人员观察到,即使受试者的日子被异常延长了四个小时,他们的体温和褪黑激素以及皮质醇水平仍继续按照他们自己的内部 24 小时昼夜节律时钟运作。 更重要的是,年龄似乎对时钟的滴答声没有影响:与之前的研究结果(表明衰老会扰乱昼夜节律)不同,哈佛研究中老年受试者的体温和激素波动与年轻组一样规律。
尽管掩体研究提供了丰富的信息,但为了研究生物钟的基因,科学家们不得不转向果蝇。 果蝇是基因研究的理想选择,因为它们寿命短且体型小,这意味着研究人员可以在实验室中繁殖和杂交数千只果蝇,直到出现有趣的突变。 为了加速突变过程,科学家通常会将果蝇暴露于称为诱变剂的引起突变的化学物质。
最早显示昼夜节律改变的果蝇突变体是在 20 世纪 70 年代早期由加州理工学院的 Ron Konopka 和 Seymour Benzer 鉴定的。 这些研究人员将诱变剂喂给一些果蝇,然后监测 2,000 只后代的运动,部分使用了与我们现在在纽约到旧金山实验中使用的设备形式相同的设备。 大多数果蝇具有正常的 24 小时昼夜节律:昆虫每天活动大约 12 小时,休息另外 12 小时。 但其中三只果蝇发生了突变,导致它们打破了这种模式。 一只果蝇的周期为 19 小时,一只果蝇的周期为 28 小时,第三只果蝇似乎根本没有昼夜节律,休息和活动似乎是随机的。
时光飞逝
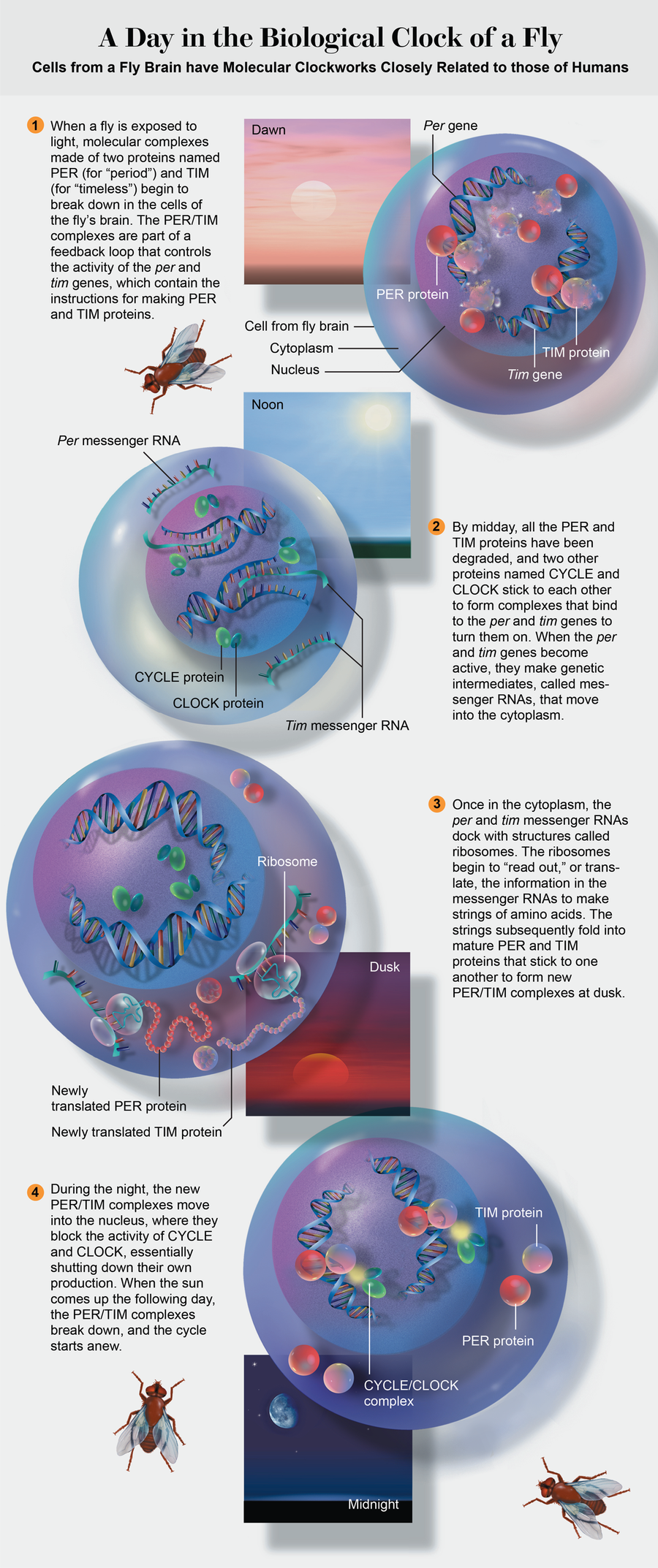
1986 年,我在洛克菲勒大学的研究小组和由布兰代斯大学的 Jeffrey Hall 和霍华德·休斯医学研究所的 Michael Rosbash 领导的另一个研究小组发现,这三只突变果蝇在单个基因period(或per)中具有三种不同的改变,我们每个团队都在两年前独立分离出了该基因。 由于同一基因的不同突变导致了这三种行为,我们得出结论,per以某种方式积极参与了果蝇昼夜节律的产生以及节律速度的设定。
在分离出per后,我们开始质疑该基因是否单独作用于控制昼夜节律。 为了找出答案,我在实验室的两名博士后研究员 Amita Sehgal 和 Jeffrey Price 筛选了 7,000 多只果蝇,看看他们是否能识别出其他节律突变体。 他们最终发现了一只果蝇,它像其中一只per突变体一样,没有明显的昼夜节律。 新的突变被证明发生在 2 号染色体上,而per已被定位到 X 染色体。 我们知道这必须是一个新基因,我们将其命名为timeless,或tim。
来源:Cynthia Turner
但是新基因与per有什么关系呢? 基因由 DNA 组成,DNA 包含制造蛋白质的指令。 DNA 永远不会离开细胞核; 它的分子配方以信使 RNA 的形式读出,信使 RNA 离开细胞核并进入细胞质,在那里制造蛋白质。 我们使用tim和per基因在实验室中制造了 PER 和 TIM 蛋白。 与哈佛医学院的 Charles Weitz 合作,我们观察到,当我们混合这两种蛋白质时,它们会粘在一起,这表明它们可能在细胞内相互作用。
在一系列实验中,我们发现 PER 和 TIM 蛋白的产生涉及类似时钟的反馈回路参见左图。 per和tim基因在它们的蛋白质浓度变得足够高之前一直处于活跃状态,以至于两者开始相互结合。 当它们结合时,它们形成复合物,进入细胞核并关闭制造它们的基因。 几个小时后,酶会降解复合物,基因再次启动,循环重新开始。
拨动时间之手
一旦我们发现了两个协同作用以制造分子时钟的基因,我们就开始想知道如何重置时钟。 毕竟,我们的睡眠-觉醒周期完全适应跨越任意数量时区的旅行,即使调整可能需要几天或几周的时间。
那时我们开始在纽约和旧金山培养箱之间来回穿梭果蝇托盘。 我们和其他人首先注意到的一件事是,每当将果蝇从黑暗的培养箱移到明亮的培养箱中以模拟日光时,果蝇大脑中的 TIM 蛋白就会在几分钟内消失。
更有趣的是,我们注意到果蝇旅行的方向会影响其 TIM 蛋白的水平。 如果我们在当地时间晚上 8 点(天黑时)将果蝇从纽约取出,然后将它们放入旧金山(当地时间下午 5 点仍然是白天),它们的 TIM 水平会骤降。 但一小时后,当旧金山的灯熄灭时,TIM 开始重新积累。 显然,果蝇的分子时钟最初因转移而停止,但在延迟后,它们在新时区的模式下恢复滴答作响。
相比之下,凌晨 4 点从旧金山移动的果蝇在被放置在纽约时经历了过早的日出,当时是早上 7 点。 这种移动也导致 TIM 水平下降,但这次蛋白质没有开始再次积累,因为分子时钟因时区切换而提前。
通过检查tim RNA 的产生时间,我们更多地了解了不同分子反应背后的机制。 tim RNA 的水平在当地时间晚上 8 点左右最高,在早上 6 点到 8 点之间最低。 当地时间晚上 8 点从纽约飞往旧金山的果蝇正在产生最高水平的tim RNA,因此在旧金山暴露于光线下损失的蛋白质很容易在新地点的日落后得到补充。 然而,凌晨 4 点从旧金山飞往纽约的果蝇在出发前产生的tim RNA 非常少。 果蝇经历的过早日出消除了 TIM,并允许下一个生产周期以更早的时间表开始。
不仅仅是虫子
让果蝇产生时差对于理解包括人类在内的哺乳动物的昼夜节律具有直接意义。 1997 年,由东京大学的 Hajime Tei 和神户大学的 Hitoshi Okamura 领导的研究人员,以及贝勒医学院的 Cheng Chi Lee 独立地分离出了小鼠和人类的per等效物。 另一波工作,这次涉及许多实验室,在 1998 年发现了小鼠和人类形式的tim。 这些基因在视交叉上核中处于活跃状态。

来源:Cynthia Turner
涉及小鼠的研究也有助于回答一个关键问题:是什么首先开启了per和tim基因的活性? 1997 年,西北大学霍华德·休斯医学研究所的 Joseph Takaha-shi 及其同事分离出一个他们称为Clock的基因,该基因突变后会产生没有明显昼夜节律的小鼠。 该基因编码一种转录因子,一种在这种情况下与 DNA 结合并允许将其读出为信使 RNA 的蛋白质。
此后不久,小鼠Clock基因的果蝇版本被分离出来,各个研究小组开始将per、tim和Clock基因的组合引入哺乳动物和果蝇细胞。 这些实验表明,CLOCK 蛋白靶向小鼠中的per基因和果蝇中的per和tim基因。 该系统已经形成了一个完整的循环:在时钟最易理解的果蝇中,CLOCK 蛋白——与一个名为cycle的基因编码的蛋白质结合——结合并激活per和tim基因,但前提是细胞核中不存在 PER 和 TIM 蛋白。 这四个基因及其蛋白质构成了果蝇生物钟的核心,并且经过一些修改,它们似乎形成了控制整个动物王国(从鱼类到青蛙、小鼠到人类)昼夜节律的机制。
最近,哈佛大学的 Steve Reppert 小组和我实验室的 Justin Blau 开始探索将小鼠和果蝇生物钟与各种行为、激素波动和其他功能的时间联系起来的具体信号。 似乎一些输出基因是通过与 CLOCK 蛋白的直接相互作用而开启的。 PER 和 TIM 阻止 CLOCK 开启这些基因的能力,同时它们产生中央反馈回路的振荡——建立基因活性循环的扩展模式。
未来一个令人兴奋的前景是恢复果蝇和小鼠等生物体中受时钟调节的整个基因系统。 很可能在这些网络中会发现以前未表征的基因产物,这些产物对行为具有有趣的影響。 也许其中之一,或分子时钟本身的组成部分,将成为缓解时差、轮班工作副作用或睡眠障碍和相关抑郁症的药物的首选靶点。 将来有一天,适应从纽约到旧金山的旅行可能会容易得多。
生物钟
作者回答了一些关键问题
生物钟在哪里? 在哺乳动物中,控制昼夜节律(称为昼夜节律的昼夜活动周期)的主时钟位于大脑中称为视交叉上核 (SCN) 的一部分。 但其他地方的细胞也显示出时钟活动。
是什么驱动时钟? 在单个 SCN 细胞内,专门的时钟基因由它们在具有 24 小时节律的反馈回路中编码的蛋白质打开和关闭。
生物钟是否依赖于正常的 24 小时昼夜循环? 不。 时钟基因活动的分子节律是天生的且自我维持的。 它们在没有昼夜环境循环的情况下仍然存在。
光在调节和重置生物钟中起什么作用? 白天视网膜吸收的强光有助于将时钟基因的活动节律与流行的环境周期同步。 夜间暴露于强光会通过急性改变某些时钟基因产物的量来重置昼夜节律。
分子时钟如何调节个体的昼夜活动? 时钟基因合成的波动蛋白控制着额外的遗传途径,这些途径将分子时钟与动物生理和行为的定时变化联系起来。
无处不在的时钟
它们不仅仅存在于大脑中
关于动物生物钟的大部分研究都集中在大脑上,但这并不是唯一观察昼夜节律的器官。
俄勒冈州立大学的 Jadwiga Giebultowicz 在果蝇肾脏状的马氏管中鉴定出了 PER 和 TIM 蛋白——生物钟的关键组成部分。 她还观察到这些蛋白质是根据昼夜节律产生的,夜间升高,白天下降。 即使在斩首的果蝇中,这种循环仍然存在,这表明马氏管细胞不仅仅是对昆虫大脑的信号做出反应。
此外,加利福尼亚州拉霍亚斯克里普斯研究所的 Steve Kay 研究小组发现了果蝇翅膀、腿、口腔区域和触角中生物钟的证据。 通过将指导荧光 PER 蛋白产生的基因转移到活果蝇中,Kay 和他的同事表明,每个组织都携带一个独立的、感光的时钟。 即使每个组织从昆虫身上解剖下来,这些时钟仍然继续发挥作用并对光做出反应。
颅外生物钟不仅限于果蝇。 日内瓦大学的 Ueli Schibler 在 1998 年表明,大鼠结缔组织细胞(称为成纤维细胞)的 per 基因根据昼夜节律活跃。
显示昼夜节律时钟活性的各种细胞类型的多样性表明,对于许多组织来说,正确的时间安排非常重要,值得在本地跟踪。 这些发现可能会给术语“生物钟”赋予新的含义。 — M.W.Y.
