人类迄今发现的最重元素被称为Og(鿫)。 每个Og原子在其致密的中心包含了惊人的118个质子。 相比之下,氢——宇宙中最丰富的元素,你可以在你的身体、地球的海洋甚至木星的大气层中找到它——只有一个质子。 科学家在2006年宣布发现了Og,当时一个俄罗斯-美国团队在俄罗斯杜布纳使用粒子加速器,向重原子靶发射了数百万万亿的钙离子。 经过1080小时的碰撞,研究人员创造了三个这种新型超重物质的原子。
几毫秒后,它们就消失了。
但是,通过仔细计算反应产生的所有辐射和较小原子,俄罗斯联合核研究所的科学家们可以相当肯定,他们在短暂的一瞬间创造了该元素。 2015年,经过十多年的审查和复核,118号元素正式加入元素周期表,成为世界物质主列表的一部分。 它以俄罗斯研究所的尤里·奥加涅相的名字命名,他是这项研究的先驱。
支持科学新闻
如果您喜欢这篇文章,请考虑通过以下方式支持我们屡获殊荣的新闻报道: 订阅。 通过购买订阅,您正在帮助确保未来能够继续讲述关于塑造我们当今世界的发现和想法的具有影响力的故事。
但是,还有多少元素尚未被发现? 仅仅在过去的十年里,科学家们一直在不断推进元素周期表,添加比以往任何时候都更重的原子。 表格上每一种基本的自然构成元素都由其原子核中包含的质子数定义。 在Og被正式承认的同时,研究人员还将包含每个原子113、115和117个质子的元素添加到元素周期表中。 我们中的一位(杜尔曼)一直在对几种所谓的超重元素进行一些首次化学实验,而布洛克一直在对其中一些元素进行首次直接质量测量和其他研究。 我们发现的每一种新元素都令人兴奋,因为它代表一种未知的物质,一种人类从未遇到过的物质形式。
然而,我们无法保留它们。 我们制造的少量原子仅存在短暂的瞬间,就会在过多带正电的质子相互排斥的压力下坍塌或转变。 但是,科学家们怀疑,某些尚未发现的超重元素和同位素(同一种元素的不同中子数的变体)可能会打破这种短暂、诱人的存在的模式。 我们设想的某些元素可能会持续数分钟,甚至数年而不会衰变。 如果是这样,它们将形成元素周期表上长期寻求的区域,称为稳定岛。 由于其原子核内部的特殊结构赋予了异常的稳定性,居住在该区域的超重元素可能不仅仅是实验室短暂的创造物,而是可以真正稳定存在。 最近,科学家们正在发现可能代表该岛屿海岸线的原子。
例如,114号元素的衰变速度比一些计算预测的原子中挤满那么多质子时要慢一些。 并且,随着中子数(原子核中不带电的质子的伴侣)的增加,最近发现的一些超重元素的半衰期——即一半原子衰变成另一种元素所需的时间——逐渐延长(尽管它们仍然非常短暂)。 这些观察结果与预测相符——传统上认为,稳定岛位于元素周期表的一个区域,那里的原子大约有114个质子,并且中子数比迄今为止创造的任何物种都多。 但是,这些略微延长的寿命——仅仅是多了一秒的一小部分的一小部分——激发了一项探索,这项探索一直是几代重元素研究人员的驱动力。 既然我们已经开始探索稳定岛,我们希望绘制出它的边界,确定其中心的位置——最稳定的同位素所在的位置——并发现这些原子可以持续多久。
近年来,科学家们对元素周期表极端区域的这些奇异居民有了令人着迷的见解。 我们的实验室技术已经发展到我们可以研究我们创造的超重元素的化学性质,并确定例如它们在室温下是金属还是气体。 而且,如果我们能够制造出一公斤的它们,这些元素可能会具有全新的——并且可能是有用的——特性,这将使它们与所有已知材料区分开来。 即使我们制造的物质持续衰变太快以至于我们永远无法将它们握在手中,它们也可以帮助我们更深入地了解化学和物质的基本性质。
探索稳定岛
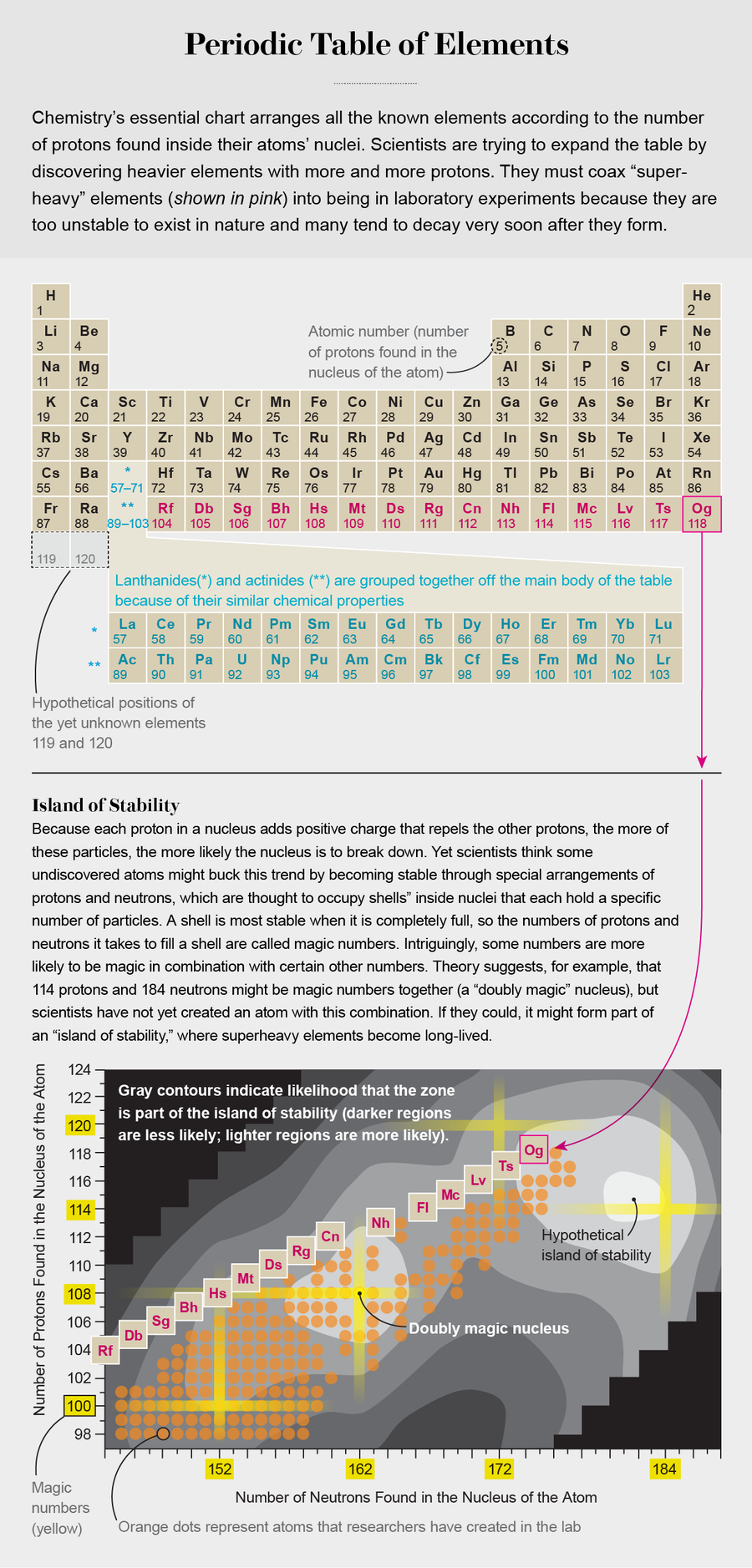
元素周期表是化学领域持续不断地尝试绘制物质基本性质的地图。 该图表是在19世纪开发的,最明确的是由化学家德米特里·门捷列夫,以及独立地由化学家尤利乌斯·洛塔尔·迈耶开发的。 它按照原子序数(每个原子中的质子数)列出元素,并将它们排列起来以显示它们与其他元素的原子反应形成化合物的方式的相似性。
几乎在元素周期表首次制定出来后,化学家们就开始思考它的延伸范围有多远。 在自然界中大量发现的最重元素是铀,其原子核包含92个质子。 但是,随着原子核内每增加一个质子,正电荷就会增加——库仑力也会随之增加,库仑力会将同性电荷相互排斥。 在某个时候,这种推力变得强于将原子核结合在一起的吸引性的“强相互作用”,原子核会分裂成碎片,这个过程称为裂变。
点击此处查看交互式元素周期表。 图片来源:Jen Christiansen; 资料来源:Christoph E. Düllmann
但是,任何特定元素的稳定性不仅仅取决于它所包含的质子数——它还取决于原子核内质子和中子的排列方式。 根据诺贝尔奖获得者玛丽亚·格佩特-梅耶和J·汉斯·D·延森在1940年代后期开发的核壳模型,构成原子核的粒子填充了所谓的核壳层。 类似于原子核内的层,可以容纳特定数量的质子和中子,它们类似于原子核周围容纳电子的电子壳层。 在这两种情况下,完整的壳层都会导致更强的结合,从而提供额外的稳定性。
科学家们在意识到对于特定的质子和中子的“幻数”(2、8、20、28、50和82),原子核更稳定且更难分裂时,构思了壳层模型。 事实证明,这些幻数对应于完整的壳层。 我们已知的原子中质子和中子的幻数是相同的,但不能保证它们会继续匹配。 质子壳层和中子壳层都充满的原子核称为双幻核。
关于幻数,我们仍然有很多不了解的地方。 例如,对于我们尚未发现的原子核,幻数是多少? 一些理论预测预测,一个双幻超重原子核将具有114个质子和184个中子。 尽管我们已经在实验室中制造了114号元素,但我们尚未制造出具有184个中子的版本。 然而,在1960年代首次提出的对这种神奇组合的预测表明,这种同位素将非常稳定,以至于其半衰期将接近地球的年龄。 这一预测是首次提出稳定岛的概念——这个概念当时激发了这个领域的兴奋,并继续推动着我们。
然而,我们仍然不知道114和184是否是真正的神奇组合。 例如,其他理论框架预测了诸如120或126个质子和172个中子的构型。 我们对未来幻数的一些预测要归功于阿尔伯特·爱因斯坦。 他解释了一个令人惊讶的观察结果,即原子的质量小于其组成质子、中子和电子的质量之和。 他著名的公式 E = mc2 表明,这种质量亏损反映了结合能——将原子核结合在一起的能量。 因此,称量具有不同质子和中子组成的原子,使我们能够识别出那些导致更强结合的构型——换句话说,代表幻数的构型——并确定它们有多稳定。
无论下一个幻数是什么,我们都认为我们开始遇到稳定岛。 实验发现,超重元素的半衰期随着中子数量的增加而增加,这表明我们正在接近下一个中子幻数。 例如,在112号元素(鎶,或Cn)的情况下,这种趋势得到了很好的体现:与Cn 277(具有112个质子和165个中子的鎶)相比,其寿命仅为约0.6毫秒,Cn 285(具有多8个中子的鎶,总共173个中子)的寿命长约50,000倍。 这种模式很可能会继续向稳定岛的中心发展,尽管是否存在无限期稳定的超重元素仍然是一个悬而未决的问题。
然而,这种可能性引发了在自然界中寻找这些元素的探索。 仅仅因为我们没有大量地看到它们,推理认为,并不意味着它们的微量储藏没有隐藏在显眼的地方。 它们可能是在诸如两颗致密恒星(称为中子星)的碰撞等强大事件中与其他比铁更重的元素一起形成的,然后散布在整个宇宙中。 在这种情况下,它们可能存在于从太空射向我们的宇宙射线中,或者可能在地球上的岩石中幸存下来。 科学家们已经使用不同的技术进行了多次搜索。 例如,预测110号元素(𨭏)当具有184个中子(一个幻数)时非常稳定,并且可能在化学上与铂相似,铂在元素周期表上直接位于其上方。 科学家们使用了诸如X射线荧光和质谱分析等技术来搜索天然铂矿石中𨭏的存在,但没有发现其含量超过十亿分之一的证据。
研究人员还在宇宙射线中寻找超重元素的迹象——例如,使用美国宇航局长期暴露设施上的超重宇宙射线实验——但他们没有发现确凿的证据。 努力肯定会继续下去,因为这样的发现将具有巨大的意义。 此外,新元素可以转化为新型材料,每种材料都具有独特的特性,可能对技术和其他应用有用。
锻造新元素
因为我们尚未在自然界中发现任何超重元素,所以我们必须自己在实验室中创造它们。 当前的任务是用更多的质子来丰富“普通”元素的原子核。 在一定程度上,我们可以通过模仿宇宙用来形成重元素的过程来做到这一点。 包含过多中子的原子核容易将其多余的中子之一转变为质子,这发生在所谓的β衰变过程中,然后产生原子序数重一个的元素。 我们可以通过用更多的中子轰击重元素来形成原子序数高达镄(100号元素)的元素。 然而,到目前为止,还没有已知的镄原子核或更重的原子核会经历相应的β衰变过程,因此这条途径到此为止。
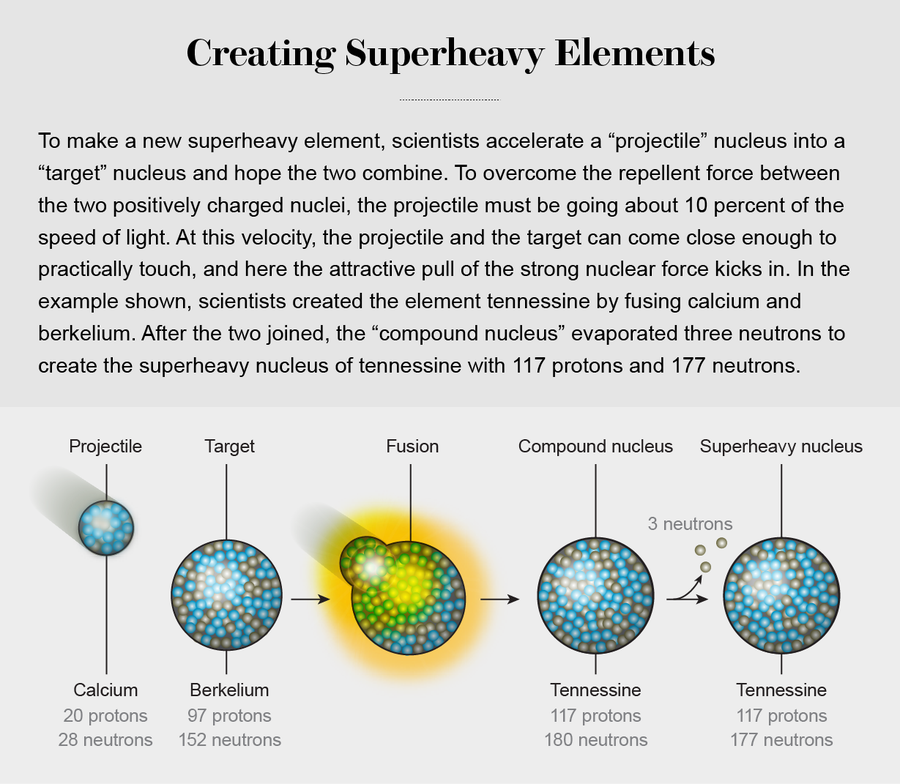
为了超越,为了创造像难以捉摸的Og这样的元素,科学家们可以将两个原子核紧密接触,以至于强力开始发挥作用。 这种力的作用范围极短,这意味着原子核必须几乎相互接触才能感受到它。 为了达到如此接近的程度,我们必须克服带正电的质子的排斥力,这意味着我们必须将其中一个原子核加速到大约光速的10%,并将其射向另一个原子核。 这种速度足以克服库仑斥力,从而使两个原子核相互表面接触。 但是,两个原子核接触的可能性非常小。 此外,将两个初始原子核合并成一个组合的原子核变得越来越不可能,系统包含的质子越多,就越不可能。 即使形成了这样的合并的“复合核”,它也经常几乎立即分裂回较轻的碎片。 这两种趋势——复合核首先形成的概率小,以及一旦形成后分裂的概率大——都强烈地不利于合成更重的元素。
尽管存在挑战,但研究人员使用这种方法取得了令人兴奋的成功。 113、115、117和118号元素,都是按照这种途径制造的,在2016年获得了官方名称。 (国际纯粹与应用化学联合会,或IUPAC,是化学领域的吉尼斯世界纪录,有权正式认可和命名新元素。)113号元素现在被称为nihonium(鉨),以纪念日本,合成该元素的实验在那里进行。 115号元素是moscovium(镆),以纪念莫斯科地区,联合核研究所的所在地,该元素在那里被发现。 117号元素被命名为tennessine(石田),以纪念田纳西州,橡树岭国家实验室在那里提供了合成新物质所需的97号元素(锫)的靶核。 具有118个质子的Og,使新的入选者名单完整。
现在,寻找119号元素的热潮开始了,这将为元素周期表增加一个全新的行。 尽管包括我们自己在内的几个小组一直在追求这些更高的原子序数,但迄今为止,没有人成功,尽管他们在世界上最强大的加速器上投入了数周甚至数月的时间。 一个障碍是,迄今为止用于合成Og的成功途径——将钙原子撞击到更重的原子核上——在118号元素处戛然而止,因为我们没有足够数量的具有超过98个质子的原子核用作靶标。 科学家们现在正试图确定哪些已知的和可用的元素组合能够提供产生新物种的最佳机会。
奇异的化学
即使这些新物种转瞬即逝地衰变,科学家们最近也在其能力上取得了突破,即在元素存在的短暂时间内进行实验,以了解它们的化学性质和特性——例如它们在室温下更像金属还是气体。
研究人员研究过化学性质的最重元素是鈇(114号元素,或Fl)。 鈇在元素周期表上的位置,在铅的下方,意味着它应该是一种典型的重金属。 但是,早在1975年的理论就表明,它实际上可能更像惰性气体——一种非常惰性的气体,很少与其他物质发生相互作用。
图片来源:Jen Christiansen
鈇的奇怪的预期行为都归结于其原子核包含多少质子,以及因此它们的带电程度有多高。 重元素原子核的极端正电荷会将其带负电的电子加速到可以达到光速80%的速度,从而导致它们以不同的轨道形状围绕这些原子核旋转,这些轨道形状的间距与较小元素的轨道形状不同。 例如,对于鈇,其最外层两个电子轨道的能级之间的间隙比类似的较小原子核(例如铅,它在元素周期表上正好位于鈇上方)要宽得多。 在铅的情况下,形成化学键将比鈇更容易提供电子克服此间隙所需的能量。 因此,鈇可能不像其较轻的对应物那样容易发生化学反应。 因此,它可能更像其他不喜欢发生化学反应的元素——惰性气体——而不是像铅这样的典型金属。
然而,很难准确预测鈇的行为。 理论普遍认为它应该比铅更惰性,但它可能比真正的惰性气体更具反应性,并且可以例如与诸如金之类的元素形成弱金属键。 因为我们还没有能够制造出足够大的量来用肉眼观察它,所以没有人知道这种元素在大量状态下会是什么样子。 一些预测表明它可能呈现银白色或淡灰色,并在室温下呈固态。
尽管我们每天只能生产出这种物质的单个原子,但鈇的有趣特性激发了科学家们不遗余力地对其进行实验。 此外,即使是寿命最长的已知Fl同位素的半衰期也只有一到两秒。 我们拥有的用于生产鈇的最佳设施之一是德国GSI亥姆霍兹重离子研究中心的反式锕系元素分离器和化学设备(TASCA)。 在那里,我们将钙48束射向覆盖有钚244的旋转靶轮。 当产生鈇原子时,磁铁将它们引导到一个称为低温在线多探测器系统,用于超锕系元素的物理和化学研究(COMPACT)。 该机器由两组32厘米长的硅探测器阵列组成,彼此相对,相隔约半毫米,形成一个狭窄的矩形通道,快速流动的气体迫使鈇通过该通道。 探测器覆盖着非常薄的金层,这使我们能够研究鈇原子如何与这种金属相互作用。 第一个探测器通道保持在室温下,但第二个通道的末端用液氮冷却至-160摄氏度以下,因为弱键——如惰性气体所表现出的那样——只有在低温下才足够强以结合鈇原子,而在较温暖的环境下则不够强。 如果鈇的行为更像金属而不是惰性气体,那么它将在通道较温暖的开始处首次接触时吸附在金上。 但是,惰性气体与金的相互作用太弱,无法在室温下保持结合,因此,如果鈇的行为更像惰性气体,则它将在通道的后一部分结合,即使有结合的话。
当我们的研究小组使用这种装置时,我们观察到两个原子都在室温探测器中衰变,这表明鈇结合,然后迅速衰变,更像金属而不是惰性气体。 然而,另一个早期的实验,由瑞士保罗·谢勒研究所的一个小组进行,并在俄罗斯弗廖罗夫核反应实验室进行,观察到三个原子。 尽管其中一个在通道的早期部分衰变,但另外两个在-90摄氏度左右的低温下被发现。 实验人员将此结果解释为暗示更像惰性气体的行为。 我们目前正在分析最近在GSI获得的数据,我们希望这些数据将阐明这种令人兴奋的元素的性质。
超重元素的突破
最近,我们中的一位(布洛克)和他的团队对超重元素——锘,或102号元素——进行了首次激光光谱实验。 他们能够通过用钙原子(20个质子)轰击铅靶(82个质子),以每秒几个粒子的速率产生锘原子。 然后,布洛克和他的同事在氩气中减慢了产生的锘原子的速度,并向它们发射激光脉冲。 如果激光脉冲的能量合适,锘电子将吸收激光能量并从原子中逃逸。 通过改变激光脉冲的频率,他们能够精确地测量从锘原子中移除电子所需的能量。 这种“电离能”是影响元素在元素周期表上位置的特征性质之一。 它决定了该元素与其他元素发生反应并形成化学键的可能性。
我们首先对同位素No 254(具有152个中子的锘的一种变体)进行了这些研究,最近将实验扩展到另外两种锘同位素No 252和No 253,以了解不同的中子含量如何改变原子电子能够吸收的能量。 结果将告诉我们这些同位素的原子核的大小和形状如何变化——带正电的原子核的不同构型将影响带负电的电子的轨道和行为方式。
科学家们还在超重元素和更普通的原子之间创建化学键,以研究这些奇异物种如何相互作用。 最近的一个例子是合成含有𨭎(106号元素)的分子。 在日本理化学研究所仁科加速器科学中心进行的实验中,杜尔曼的小组领导一个团队,生产出半衰期约为10秒的𨭎同位素原子。 然后,科学家们向含有𨭎的腔室中添加了一氧化碳,并发现重元素转变成六羰基化合物,其中六个一氧化碳分子与中心𨭎原子结合。
杜尔曼和他的同事们发现,在这种情况下,𨭎的行为很像其较轻且更熟悉的同系物钨和钼,它们具有相同数量的价电子。 在一项为期约两周、昼夜不停的𨭎实验中,研究人员观察到𨭎与一氧化碳分子形成与钼和钨相同类型的化合物,速率相似。 科学家们现在正转向测试这三种元素中哪一种与一氧化碳形成最稳定的键——1990年代后期进行的计算表明将是𨭎,但最近和更高级的计算预测𨭎与一氧化碳的键将比钨的键弱。
这些只是当前正在进行的超重元素实验以及我们希望回答的许多未解决问题的几个例子。 尽管元素周期表中这些最新的成员无疑非常奇异,但实验研究提供了越来越多的直接信息,说明它们如何融入我们日常生活中遇到的更常见元素所建立的相同元素系统。 无论它们是不稳定的还是长寿命的——实际上,无论我们是否找到稳定岛的中心——超重元素都可以在自然界化学构建基块的运作方式方面教给我们很多东西。

