脑癌令人恐惧。它攻击我们视为个性的核心、我们的思想、我们人性的器官。而且由于这种疾病在大脑内部生长,因此非常难以治疗。该器官进化出许多防御机制,以阻止外来物质进入,作为一种自我保护的方法,但这些物质包括许多抗癌药物。对这个意识堡垒使用手术刀或放射线会带来巨大的风险。由于这些原因,55 岁至 64 岁患上胶质母细胞瘤(最常见的原发性脑肿瘤类型)的人的五年相对生存率非常严峻,仅为 5%。这种疾病夺去了约翰·麦凯恩、爱德华·肯尼迪和博·拜登的生命,并且每年夺走约 15,000 名不太出名的美国人的生命。
现在我们开发了一种纳米尺寸的药物,它可以在体内和大脑中穿行,杀死癌细胞。这些药物颗粒由寡核苷酸组成——DNA 或 RNA 链,这些分子构成了主代码,告诉每个细胞该做什么——它们像海胆的许多刺一样从中心核伸出。这些带刺的圆形颗粒被称为球形核酸。在一项针对八名患者的早期试验中,这些球体进入胶质母细胞瘤细胞,并结合了其他对癌症持续生长至关重要的“代码”分子。
这种球形药物似乎对多种疾病有效。另一种可怕的疾病是脊髓性肌萎缩症 (SMA),它会影响婴儿。它剥夺了儿童的肌肉控制能力,直到吞咽和呼吸变得先是困难,最终变得不可能。大多数患有这种疾病的儿童在进入幼儿园之前就去世了,而且直到最近,医生还无法提供任何帮助。2016 年,美国食品和药物管理局批准了一种疗法:一种名为 Spinraza 的药物,每年多次直接注射到脊髓中,每次注射的标价为 125,000 美元,是世界上最昂贵的药物之一。最近,我们在啮齿动物研究中,将我们的球体(上面布满了进入细胞并干扰导致 SMA 症状的信使分子的核酸)与 Spinraza 方法进行了比较。球体将生存期提高了四倍——115 天对 28 天——而且毒副作用的发生率要低得多。
关于支持科学新闻报道
如果您喜欢这篇文章,请考虑通过以下方式支持我们屡获殊荣的新闻报道 订阅。通过购买订阅,您将有助于确保有关塑造我们当今世界的发现和想法的具有影响力的故事的未来。
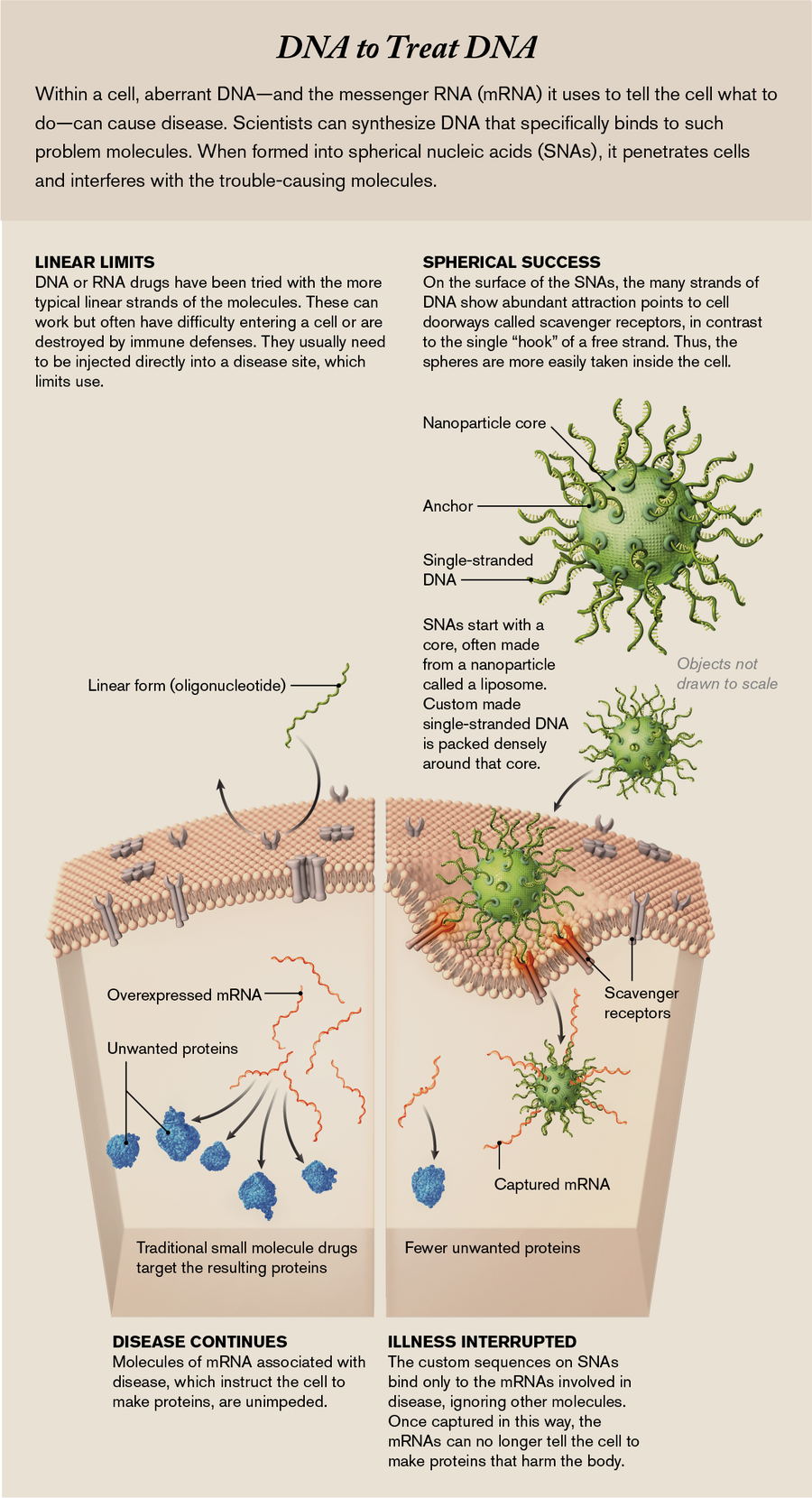
球形核酸 (SNA) 避免了困扰制药行业开发新药的难题。传统药物是非特异性的:它们会影响许多细胞和器官,而不仅仅是患病细胞;因此,它们有许多副作用。然而,核酸可以被设计成仅干扰致病基因或其发送的控制细胞行为的相关指令分子。生物学家过去曾尝试使用核酸,但主要是作为线性分子,并且几乎没有能力指导它们去哪里。而且由于人体对外来遗传物质具有强大的防御能力——例如免疫系统——在大多数情况下,这些防御机制会立即破坏药物或将药物送到肝脏和肾脏等器官进行废物清除。
但是,SNA 的直径只有十亿分之一米,似乎能够到达体内的任何地方,并在免疫防御系统拦截它们之前进入细胞内部。球形形状使我们能够将高密度的核酸“刺” packed 到一个小空间中,这种密度与细胞表面上的受体产生强烈的相互作用,从而允许颗粒进入细胞内部。在那里,成分的序列——与构成生命 DNA 代码的核苷酸相同,缩写为 A、T、C 和 G——确保它们仅影响 DNA 或 RNA 的互补序列。(后一种分子使用 U(尿嘧啶)代替 T,我们为此进行了设计。)我们构建我们的链,使其仅与细胞中对疾病至关重要的序列匹配。SNA 不是灵丹妙药,在可以用于大量患者之前,还需要通过更多测试。但潜力是存在的:由于可以重新排列核酸成分以干扰细胞内许多不同的致病分子,因此球体有能力解决世界上一些最令人衰弱的疾病。
可编程药物
传统上,科学家们通过筛选数十万种小的合成或天然分子来寻找疾病治疗方法,经历漫长的反复试验过程,以查看其中是否有任何一种具有治疗益处。尽管这种流程已经产生了许多令人惊叹的药物,例如抗生素,但即使是最有希望的药物也可能引起不必要的副作用。许多其他疾病不受这些分子的影响,因此仍然缺乏治愈或治疗方法。即使是生物制剂,一种较新的药物类别,通常基于小鼠、兔子和其他动物的免疫细胞产生的蛋白质,也通常依赖于简化的反复试验发现过程。
理想的药物设计过程将允许科学家快速、合理地设计使用与我们的细胞相同的语言的特定药物,而不是寻找大海捞针般的分子。细胞通过 DNA 和 RNA 传递许多复杂的信息,以制造数百万种蛋白质。细胞必须正确执行以制造这些蛋白质的步骤数量令人震惊:它们必须选择由 A、T、C 和 G 核苷酸组成的 DNA 的特定序列,将该序列转录成一种称为信使 RNA (mRNA) 的形式,然后准确读取该 mRNA 以将称为氨基酸的分子排列成链——长达 35,000 个单位——形成单个蛋白质。
当添加、删除或以不正确的顺序放置诸如 T 或 G 之类的核苷酸时发生的错误可能会阻止蛋白质的产生或产生导致疾病的异常蛋白质。mRNA 的副本过多,因此其相关蛋白质的副本过多也可能导致疾病。(来自病毒的外来核酸的引入也会导致疾病,这会导致受感染的细胞制造有害的病毒蛋白质。)
但是我们可以合成我们自己的 DNA 或 RNA 成分片段,称为寡核苷酸。由于遗传字母表具有非常具体的规则——A 只能与 T 结合,而 C 只能与 G 结合——我们可以制造具有选择性结合并灭活一种疾病驱动序列的序列的寡核苷酸。当它们这样做时,合成的寡核苷酸会阻碍细胞工作,阻止受影响的细胞产生致病蛋白质。
然而,尽管有自动化设备可以快速制造具有任何所需序列的合成寡核苷酸,但只有不到十几种基于寡核苷酸的药物已获得患者批准。这是因为这些寡核苷酸链一旦被注射到血液中,就会面临一个重大障碍:因为它们是外来的——也就是说,不是患者自身的——它们会被视为有害物质或废物。人体的免疫系统会破坏这些寡核苷酸,或者人体的废物过滤站(肝脏和肾脏)会将它们清除。它们无法到达预期的目标。即使寡核苷酸链能够到达含有目标 mRNA 的细胞,该细胞也具有充当屏障的外膜,以阻止寡核苷酸进入内部。因此,与寡核苷酸合作的制药公司通常会选择治疗可以在肝脏中靶向的疾病。肝脏是一个重要的器官。但是将这些药物隔离在这个地方确实限制了它们的用途。(另一种方法——将寡核苷酸直接注射到疾病部位,例如使用 Spinraza 注射到脊髓中——技术上很困难,并且仍然不能确保药物进入所有适当的细胞。)
图片来源:艾米丽·库珀
一个令人惊讶的结果
我们西北大学的小组以及其他几位研究人员在纳米技术方面的进展使我们发现了 SNA,这可能是解决这个问题的一种方法。在 2006 年之前,我们的小组一直对在超灵敏诊断探针中使用 SNA 的高度特异性结合能力感兴趣——例如,从血液样本中提取癌 DNA 片段。我们可以通过化学方式用许多 DNA 链装饰金纳米颗粒来实现这一点,这些 DNA 链被设计成将一端锚定到颗粒上,从而产生海胆刺图案。DNA 的外端被设计成与癌 DNA 序列互补的序列,因此它可以很好地用作探针。我们还将球体用作具有可编程键的人造原子,以制造新型材料。然而,药物设计实际上并不在我们的雷达范围内。毕竟,根据药物生物学和化学的主流范式,RNA 和 DNA 不会自然地穿过细胞膜。
然而,我们对这种新几何结构中的核酸如何与生命系统相互作用感到好奇。药物开发人员已经一直在试验单链寡核苷酸,正如我们所指出的,效果有限。从我们使用 SNA 作为诊断平台的研究中,我们知道目标 DNA 和 RNA 与我们的刺簇的结合力将比与游离寡核苷酸链的结合力强得多。原因是我们的刺密集地 packed 在纳米颗粒的表面上。这使得它们更坚硬,这有助于每条链上的 A、T、G 和 C 在遇到目标链时对齐和结合。这一特性使我们怀疑,如果使用正确的核酸序列,SNA 可能是一种非常有效的寡核苷酸药物。
为了验证这个想法,我们进行了一项实验,当时我们认为这项实验成功的机会很渺茫。我们取了游离寡核苷酸链,并将它们放入装有小鼠细胞的试管中。在另一个试管中,我们将大量 SNA 添加到相同类型的小鼠细胞中。我们将红色荧光分子附着到球体和链上,以帮助我们追踪它们。当我们用显微镜观察细胞时,与游离链混合的细胞如预期的那样呈透明状。游离寡核苷酸没有穿过细胞膜。但是与 SNA 混合的细胞在屏幕上亮起了鲜红色的荧光。球体进入了细胞内部!
这怎么可能发生呢?一般来说,细胞膜严格调节哪些分子可以进入,而寡核苷酸通常不在批准的客人之列。此外,寡核苷酸带有负电荷,细胞表面也是如此。就像两个磁铁一样,这两个生物物体应该相互排斥。然而,当我们一次又一次地重复这项实验,使用超过 50 种其他人类和动物细胞类型时,除了一个细胞外,所有细胞都发出红光,这是成功的信号。
今天,我们认为我们知道入口是什么:一种称为清道夫受体的门户分子,它点缀在细胞表面。当细胞与其环境相互作用时,这些受体发挥着重要作用;例如,它们允许细胞需要的纳米尺寸的生物分子进入。SNA 刺末端的一些结构特征恰好模仿了这些清道夫受体的天然底物。正如前面提到的,球体上的链条 packed 得很密集,就像 Velcro 一样,钩子越多,结合力就越强。对于游离链,即使清道夫受体将它们识别为要摄取的分子,它们也只有一个钩子,然后就漂走了。
借助电子显微镜,我们可以看到,一旦 SNA 与这些受体结合,周围的细胞膜就会向内折叠形成一个口袋,将 SNA 引入细胞内部。
球体作为药物
但是进入只是成功了一半。要作为药物发挥作用,SNA 需要找到、结合并灭活 mRNA 的特定片段,该片段指示细胞制造与疾病相关的蛋白质。
我们在细胞中靶向的第一个 mRNA 片段不会引起疾病,但确实指示细胞制造一种在显微镜下发出亮绿色的蛋白质。我们的目标是阻止这种 mRNA。当我们用设计用于匹配绿色致病 mRNA 的 SNA 暴露小鼠细胞,并将它们与未获得球体的类似细胞进行比较时,颜色差异很明显。没有球体的细胞呈亮绿色,表明 mRNA 已经编码了蛋白质。但是暴露于我们的 SNA 的细胞是透明的,这意味着我们已经阻止了 mRNA,使其无法传递指令来制造任何绿色的东西,正如我们在 2006 年的《科学》杂志上报道的那样。
接下来,我们将 SNA 与困扰线性寡核苷酸药物的主要挑战进行了对抗:被人体自然防御系统破坏。我们发现,我们的球体具有很强的电荷——再次是因为密集的 packed ——这有助于它们逃避免疫干扰。这种高电荷会抑制称为核酸酶的防御分子,核酸酶是降解外来 DNA 和 RNA 的蛋白质,使其无法靠近。
现实检验
至少在实验室里,我们取得了一些进展。其他科学家复制并独立推进了我们的一些工作,包括皮肤科医生艾米·帕勒、SMA 专家亚瑟·伯格斯、免疫治疗专家张斌、癌症生物学家亚历克斯·施特格、移植外科医生杰森·韦特海姆和肿瘤学家普里亚·库姆特卡尔。但是从实验台突破到更健康的患者的道路漫长而艰辛,因此大约 10 年前,我们小组的研究人员成立了一家名为 Exicure 的公司,以将基于 SNA 的药物推进到临床。
我们最初探索了是否可以将这些强效药物通过皮肤霜和滴眼液输送到患病组织,这是可行的,因为 SNA 很容易被细胞吸收,并且比直接注射等侵入性策略有了很大的改进。我们的最初两个目标是牛皮癣和难以愈合的伤口,并且已经有几个有希望的 SNA 候选药物正在针对其中一些疾病进行早期临床试验。
当然,皮肤相对容易到达。大脑则不然。大脑受到警惕的免疫系统和旨在阻止外来分子进入的血管网络(血脑屏障)的保护,使得胶质母细胞瘤等癌症特别难以治疗。然而,我们认为 SNA 可能会通过相同的门户分子穿过这些防御系统,这些门户分子可以使它们更容易穿过细胞膜。一旦进入大脑,球体就可以通过靶向负责维持细胞存活的基因和蛋白质(恶性肿瘤会过度产生这些基因和蛋白质)来定位癌细胞。
为了启动这个项目,我们创造了一种 SNA 药物,其中包含许多短 RNA 片段,专门设计用于敲除胶质母细胞瘤细胞中一种名为 Bcl2L12 的蛋白质的产生。这种蛋白质充当生化防御剂,有助于维持癌细胞的功能。我们认为,通过拦截告诉细胞制造这种蛋白质的 mRNA,SNA 可以使癌症更容易受到传统药物的影响。事实上,在我们在 2013 年的《科学转化医学》杂志上报道的动物研究中,情况就是这样:注射到小鼠血液中的 SNA 到达大脑,穿过血脑屏障,并阻止了胶质母细胞瘤细胞内部 Bcl2L12 蛋白质的产生。去年,早期临床结果表明,这些 SNA 也到达了人类患者的胶质母细胞瘤细胞。我们没有治愈人们,我们还没有测试 SNA 是否使癌细胞更容易受到攻击。尽管如此,SNA 到达大脑的能力及其缺乏毒性为治疗这种癌症以及其他神经系统疾病带来了希望,并为下一组临床试验奠定了基础。在其他疾病(如脊髓性肌萎缩症)中的测试也显示出在动物身上的前景。
SNA 的另一个令人兴奋的方向是将其用作针对癌症的免疫疗法。癌细胞的膜中通常具有与健康细胞中发现的蛋白质不同的蛋白质。因此,癌细胞蛋白质可以充当危险信号,如果我们的免疫系统可以被训练成像追逐流感病毒一样追逐它,我们自己的身体就可以更好地保护我们免受这种疾病的侵害。
为了制造 SNA 癌症疫苗,我们将金纳米颗粒核替换为空心纳米颗粒,称为脂质体,用其中一种危险信号蛋白质填充它,并将其注射到患有相应癌症的动物体内。我们最近的一些实验发表在 2019 年的《美国国家科学院院刊》上,表明这种 SNA 会立即引发对肿瘤的免疫反应,显然是在教导免疫系统追逐显示该危险信号的细胞。效果似乎也很持久:即使 SNA 消失后,免疫系统仍会继续追逐带有该蛋白质的细胞。SNA 已经在人体 I 期临床试验中显示出效力和安全性,并且针对致命性皮肤癌的其他球体正在另一组安全性试验中进行测试。
然而,SNA 尚未成为批准的药物。它们首先需要克服许多挑战。由于球体确实会到达广泛的细胞,我们需要仔细研究它们是否会产生任何负面的“脱靶”效应,即使它们的设计应该将它们限制为仅针对问题 DNA 和 RNA。必须探索更大的患者群体,并且我们需要改进靶向性,以增加到达受影响器官和细胞的药物量。
我们认为 SNA 访问如此多不同组织的能力具有颠覆性,并将成为此类药物出现和最终广泛使用的核心。SNA 是三种核心能力的产物:制造大量寡核苷酸的能力、对遗传疾病途径的理解以及将此类寡核苷酸送入重要组织和细胞的能力。前两者很重要,但没有第三者,这个过程就像制造软件而没有运行它所需的硬件。SNA 可能是那种至关重要且用途广泛的硬件——一个能够为许多不同类型的疾病重复使用的平台,一个开始将制药行业从为每种新疗法艰难寻找全新分子的困境中解脱出来的平台。SNA 只需要一组不同的寡核苷酸就可以追逐一种新的疾病。而我们才刚刚开始。
