罗伯特·索格在2009年研究小鼠的疼痛,但最终头痛的是他自己。
在加拿大蒙特利尔的麦吉尔大学,索格正在研究动物如何产生对触摸的极端敏感性。为了测试这种反应,索格用细毛戳小鼠的爪子,这些细毛通常不会打扰它们。雄性小鼠的行为正如科学文献所说的那样:即使是最细的线,它们也会猛地缩回爪子。
但雌性小鼠对索格的轻柔戳刺保持了沉默。“在雌性身上就是不起作用,”索格回忆道,他现在是阿拉巴马大学伯明翰分校的行为学家。“我们无法弄清楚原因。”索格和他在麦吉尔大学的导师,疼痛研究员杰弗里·莫吉尔,继续确定这种疼痛过敏是由雄性和雌性小鼠中截然不同的途径产生的,不同的免疫细胞类型导致了不适。
支持科学新闻业
如果您喜欢这篇文章,请考虑通过以下方式支持我们屡获殊荣的新闻业 订阅。通过购买订阅,您正在帮助确保有关塑造我们当今世界的发现和想法的有影响力的故事的未来。
如果索格和莫吉尔遵循大多数疼痛研究人员的惯例,他们永远不会做出他们的发现。通过纳入雄性和雌性小鼠,他们是在逆潮流而动。当时,许多疼痛科学家担心雌性激素周期会使结果复杂化。其他人则坚持使用雄性,因为,嗯,事情就是这样做的。
今天,部分受到索格和莫吉尔工作的启发,并受到资助者的推动,疼痛研究人员正在睁开眼睛关注不同性别之间的反应谱。结果开始逐渐显现,并且很明显,某些疼痛途径差异很大,免疫细胞和激素在不同的反应中起着关键作用。
这种推动是更广泛的运动的一部分,即将性别视为生物医学研究中的一个重要变量,以确保研究涵盖各种可能性,而不是从单一群体中收集结果。2016年,美国国立卫生研究院 (NIH) 做出了一项重大改变,要求拨款申请者证明他们选择实验动物性别的合理性。加拿大卫生研究院性别与健康研究所科学主任卡拉·坦嫩鲍姆说,疼痛研究中的发现是最令人兴奋的新兴领域之一。她补充说,关于索格和莫吉尔的工作,“据我所知,没有其他科学领域发现过这种类型的性别差异。”
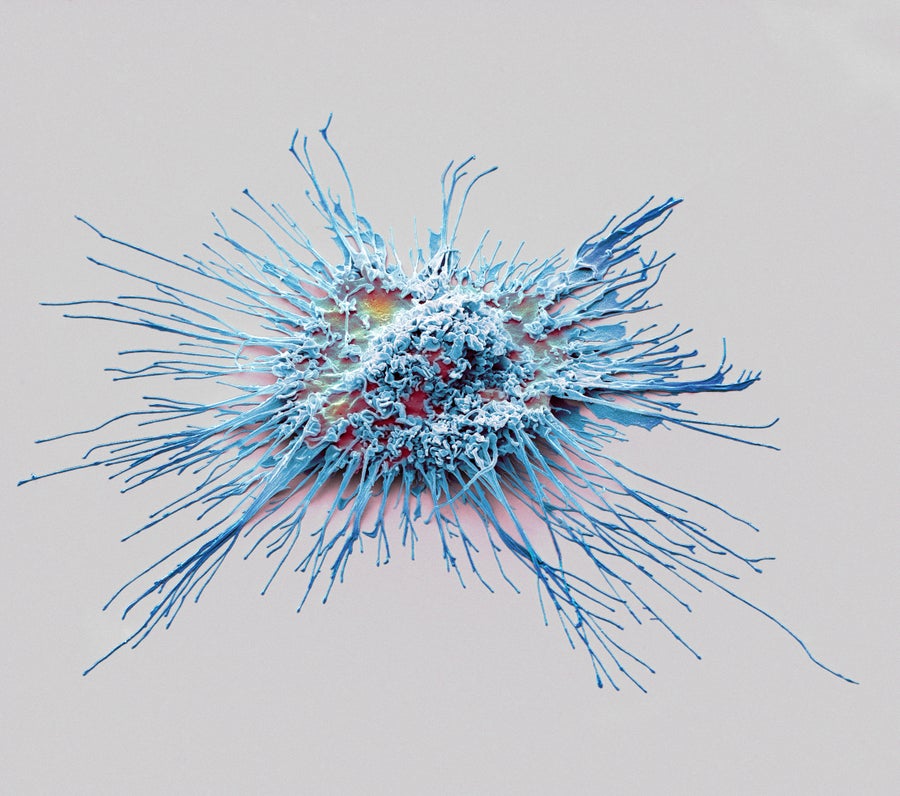
小胶质细胞是神经系统的免疫细胞,是雄性小鼠疼痛形式的幕后推手。
图片来源:Steve Gschmeissner Getty Images
坦嫩鲍姆补充说,这项研究可能会为新的医学进展打开大门。这些进展是迫切需要的:全世界约有 20% 的人经历慢性疼痛,其中大多数是女性。今天,制药市场向所有人提供相同的止痛药。但如果疼痛的根源不同,那么某些药物可能比其他药物在某些人身上效果更好。
此外,当激素水平在生活中波动时,人们可能需要不同的止痛药。并且一个人的性别并不总是清晰地分为男性和女性类别:它由一系列特征决定,包括遗传、解剖发育和激素水平,每种特征都可能影响一个人在疼痛治疗中的需求。情况远未完善,并且研究(大多数在啮齿动物身上进行)到目前为止主要集中在生物性别上,而不是性别,性别是一个不一定与性别相符的社会心理概念。
英国剑桥阿斯利康公司神经科学副总裁兼主管伊恩·切塞尔预测,未来的止痛药将为个人量身定制,而性别将是这些个性化处方的关键因素。“但我们还不了解它,”他补充道。
对疼痛免疫
当皮肤、肌肉、关节或器官中的神经传感器记录到潜在的有害感觉(例如热或组织损伤)时,就会发生疼痛。它们通过周围神经向脊髓发送信号,激活其他神经,这些神经将信号发送到脑干,然后发送到大脑皮层,大脑皮层将这些信号解释为“哎哟!” 但疼痛的发生方式有很多种,并且涉及多种化学途径。一些疼痛类型通过时间来区分。有对热、尖锐或其他有害物质的急性反应,也有长期慢性疼痛,即使在最初的损伤愈合后也可能持续存在。
慢性疼痛可以表现为对原本无痛刺激的过敏,就像索格的雄性小鼠的情况一样。早在 2009 年,他和莫吉尔就在研究一种由炎症引发的慢性疼痛模型。
将一种名为脂多糖的细菌分子注射到小鼠的脊柱中引起了小胶质细胞(神经系统常驻免疫细胞)的注意。但在索格的研究中,这仅导致雄性小鼠的炎症,解释了为什么它们对毛发刺激测试如此敏感,索格和莫吉尔在 2011 年报告中指出。雌性小鼠的小胶质细胞保持静止,这似乎解释了它们对索格用细毛戳它们的爪子无动于衷的原因。
为了更好地理解为什么雄性和雌性小鼠对疼痛的处理方式如此不同,索格和莫吉尔转向了一种影响所有小鼠的疼痛来源。他们损伤了动物的坐骨神经,坐骨神经从下背部向下延伸到每条腿。这导致了一种慢性疼痛形式,当身体的疼痛检测系统受损或发生故障时就会发生。这导致雄性和雌性小鼠都变得对触摸格外敏感。
但即使在这种情况下,也存在差异。小胶质细胞似乎在雄性小鼠的疼痛中起着重要作用,但在雌性小鼠的疼痛中则不然。索格和一个来自三个机构的合作团队发现,无论他们如何阻断小胶质细胞,这都只消除了雄性小鼠的疼痛过敏。
并不是说雌性小鼠对疼痛免疫。它们和雄性小鼠一样受到神经损伤的困扰,但它们没有使用小胶质细胞来变得对触摸过敏。莫吉尔和索格想知道另一种称为 T 细胞的免疫成分是否是雌性小鼠慢性疼痛的幕后推手。已知这些细胞在小鼠的疼痛敏化中起作用。
索格在缺乏 T 细胞的雌性小鼠身上尝试了相同的神经损伤。它们仍然对细毛变得过敏,但现在的机制似乎是通过小胶质细胞发生的。在缺乏 T 细胞的雌性小鼠中,阻断小胶质细胞的活动可以阻止这种疼痛反应,就像在雄性小鼠中一样。当研究人员将 T 细胞转移回缺乏 T 细胞的雌性小鼠时,这些动物停止在神经损伤疼痛中使用小胶质细胞(参见两种疼痛途径)。
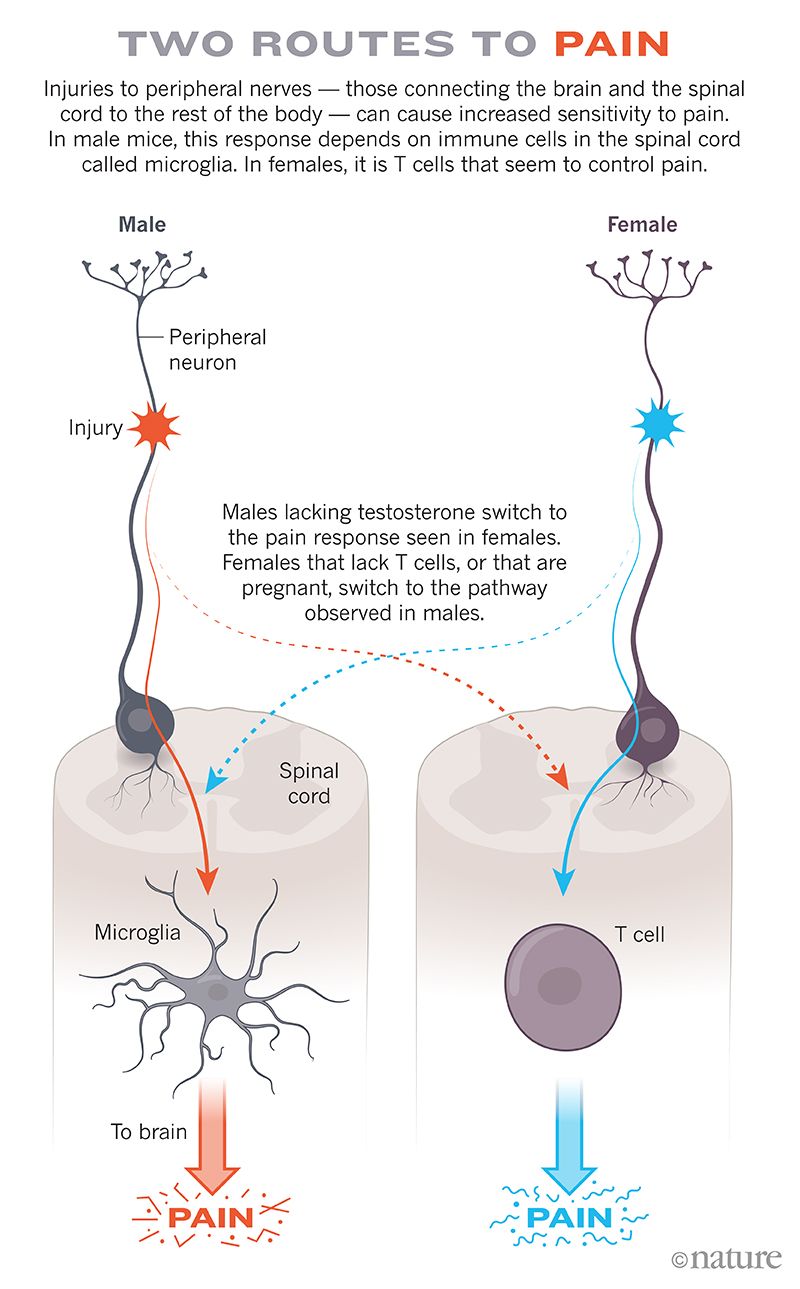
德克萨斯大学达拉斯分校的神经药理学家格雷格·杜索尔说,该团队在 2015 年报告的发现对疼痛领域产生了重大影响。结果表明,即使从外部来看,每个人的疼痛可能看起来相似,但科学家不能假设内部也是相同的。
痛点
如果动物可以在疼痛途径之间切换,是什么控制了这种切换?研究人员长期以来将疼痛感知的性别差异归因于雌激素,雌激素是一种控制子宫、卵巢和乳房发育的激素,并调节月经周期。雌激素可以加剧或减轻疼痛,具体取决于其浓度和位置。睾酮是参与阴茎、睾丸和前列腺发育以及第二性征(如体毛)的激素,受到的疼痛研究人员的关注较少,尽管研究表明它可以减轻疼痛,并且一些患有慢性疼痛的人接受睾酮治疗。
在小胶质细胞和疼痛过敏的情况下,莫吉尔的研究直接指向睾酮作为疼痛途径的控制开关。在 2011 年和 2015 年的研究中,当索格测试去势雄性小鼠(睾酮水平低)时,这些动物表现出与雌性相似的反应。当研究人员向去势雄性或雌性提供睾酮时,疼痛途径切换为依赖小胶质细胞的途径。
从那时起,研究人员继续发现证据,证实小胶质细胞及其酶和受体在雄性小鼠经历疼痛中的重要性。这种现象并不局限于小鼠:莫吉尔的合作者之一,神经科学家迈克尔·索尔特,也在患有神经损伤引起的过敏的大鼠雄性身上发现了小胶质细胞受体在起作用。索尔特是加拿大多伦多病童医院的研究主管,他现在正在猕猴身上研究这个问题,猕猴处理疼痛的方式可能与人类更相似。
在人类身上研究这些疼痛途径要困难得多,但线索正在浮出水面。德克萨斯大学达拉斯分校的神经药理学家泰德·普莱斯和他的合作者在 3 月份发表了初步证据,表明免疫细胞在人类疼痛中的作用方式存在差异。
他们正在研究从癌症患者身上取出的神经组织,这些患者的肿瘤已经侵入了他们的脊柱。在从经历疼痛的男性身上切除的神经中,普莱斯的团队发现了由一种称为巨噬细胞的免疫细胞引起的炎症迹象。这些细胞的功能与小胶质细胞相似。然而,在疼痛的女性中,更重要的参与者似乎是神经细胞本身和一段刺激神经生长的蛋白质构建块(称为肽)。普莱斯说,结果表明人类和啮齿动物的性别差异之间存在相似之处。
但免疫细胞和激素并不能完全解释疼痛差异。例如,北卡罗来纳大学教堂山分校医学中心的转化生物学家莎拉·林斯塔特发现,一些女性可能具有慢性疼痛的遗传倾向。她的团队在血液中发现了一组 RNA 分子,这些分子更有可能在机动车事故后患上慢性颈部、肩部或背部疼痛的女性中升高。这些 RNA 分子中的许多是由 X 染色体上的基因编码的,大多数女性都有两个 X 染色体副本。
林斯塔特说,这是有用的信息。“这将使我们能够开发新的疗法,这些疗法可以专门用于女性,或者在女性中以更高的剂量使用。”
药物差异
其他人也在考虑针对性别的止痛治疗。在 2018 年 11 月在线发表的一项研究中,普莱斯和他的团队报告说,一种名为二甲双胍的糖尿病药物可以减少脊髓感觉神经元周围的小胶质细胞数量。他们还表明,该药物仅能阻断雄性小鼠神经损伤引起的疼痛过敏。“它对雌性没有任何作用;事实上,情况变得更糟,”普莱斯说,他对原因有一个理论:为了进入神经系统,二甲双胍依赖于一种在雄性细胞中表达水平更高的蛋白质。然而,更高的剂量并没有对雌性产生影响,大概是因为药物被困在神经之外。
更高的剂量确实可以帮助接受药房中最古老的止痛药之一:吗啡的女性。佐治亚州立大学亚特兰大分校的神经科学家安妮·墨菲说,女性和雌性啮齿动物通常需要更高剂量的吗啡才能达到与男性和雄性啮齿动物相同的止痛效果。她是少数在 NIH 更改其指南之前就研究性别差异的研究人员之一。
墨菲的团队在 2017 年报告称,小胶质细胞也是吗啡不同效果的幕后推手。该药物通过阻断大脑中称为导水管周围灰质或 PAG 的区域中的神经元来减轻疼痛。但该药物也可能激活那里的小胶质细胞,抵消吗啡的止痛效果。这正是发生在雌性大鼠身上的情况,雌性大鼠的 PAG 中的小胶质细胞比雄性更活跃。当科学家在雌性大鼠爪子上应用热光束之前用吗啡治疗它们时,雌性动物的 PAG 中炎症更多,并且比给予相同剂量的雄性更快地缩回腿。当墨菲的团队阻断吗啡对小胶质细胞的影响时,雄性和雌性对疼痛的反应方式相似。
至少有一种已经上市的药物,科学家有理由认为它可能在不同性别之间发挥不同的作用。2018 年,美国食品和药物管理局批准了基于抗 CGRP 抗体的偏头痛治疗方法,CGRP 是一种在神经系统中发现的肽,与此类头痛有关。偏头痛对女性的影响是男性的三倍。
在普莱斯和杜索尔领导的一项尚未发表的小鼠和大鼠研究中,研究小组将 CGRP 应用于大脑周围的厚膜。在雌性中,这种肽产生了一种看起来像偏头痛的反应:动物们做了鬼脸,它们的脸部对触摸过敏。在雄性中:“什么也没有,”杜索尔说。现代抗 CGRP 药物可能在女性身上比在男性身上效果更好,他补充说,但该药物的临床试验并未检查此类效果。
这在许多药物试验中都很典型。它们通常包括男性和女性,但每种性别的数量通常都不足以找出差异。普莱斯说,过去临床试验失败的止痛药,如果按性别分别进行测试,则很有可能获得成功。“这似乎非常明显,”他补充道,“但实际上没有人这样做。”
个性化药丸
阿斯利康公司的切塞尔很乐意开发一种仅对特定性别的人有效的止痛药。但研究参与者和动物受试者的性别是由实用性、伦理问题和政府法规驱动的,他说。阿斯利康在其大多数临床前疼痛研究中使用雌性啮齿动物,因为它们不如雄性具有攻击性,并且更容易饲养和处理。在早期临床试验中,安全是重点,因此公司通常排除可能怀孕的人。因此,药物主要在男性和绝经后女性身上进行试验。
即使科学家开发出针对男性或女性特定疼痛途径的药物,这些药物可能也不够。最好更密切地定制药物,以考虑到遗传、激素水平和解剖发育的谱系。
关于不符合性别和性别二元定义的人的疼痛机制的研究很少。在一项研究中,意大利的研究人员调查了接受激素治疗的跨性别者。他们发现,在 47 名从男性转变为女性的人中,有 11 人报告了变性后出现的疼痛问题。在 26 名从女性转变为男性的人中,有 6 人报告说服用睾酮后疼痛问题减轻了。
根据他的团队在小鼠身上进行的去势和睾酮治疗实验,莫吉尔认为疼痛途径将由激素水平决定。他预测,睾酮水平超过一定阈值的人将具有与男性相关的疼痛机制,而睾酮水平低于该水平的人将通过女性常见的机制体验疼痛。
疼痛反应似乎也会在一生中发生变化,在激素水平升高或下降的时候。仅关注生物性别的研究发现,在青春期,女孩的疼痛状况发生率高于男孩。随着人们年龄的增长,有些人进入更年期,激素水平再次发生变化,慢性疼痛发生率的性别差异开始消失。怀孕也会改变疼痛反应。莫吉尔的研究小组在 2017 年报告称,在怀孕早期,小鼠从典型的女性、不依赖小胶质细胞的疼痛敏化机制转变为更男性相关的、涉及小胶质细胞的机制。到怀孕后期,动物似乎根本感觉不到慢性疼痛。
但他不再是少数几个寻找这种性别差异的科学家之一。“人们现在左右都在发现这一点,”莫吉尔说。“我认为我们现在只知道了一半。”
本文经许可转载,并于 首次发表 于 2019 年 3 月 29 日。