基因疗法在人体中经历了三十年的蹒跚起步后,正逐渐成为少量但不断增长的疾病的治疗选择。尽管在 1970 年代提出这一概念时,它面临着科学和伦理方面的不确定性,但该方法的基础——替换或修复单个致病基因——已被证明是可靠的。研究人员已经开发出不同的方法来纠正或影响某人基因的功能方式,并利用这些技术为多种血液疾病以及退行性眼病和肌肉疾病创建了疗法。过去五年中,美国已批准了六种以上的此类疗法,并且针对各种疾病的许多其他疗法正在朝着临床试验迈进。
现有的基因疗法依赖于两种基本方法。更常见的方法是从患者身上抽取血液,并在实验室中对特定细胞进行重新编程,然后再将它们重新注入人体。另一种方法是将基因疗法直接输送到体内,通常是更容易触及的区域,例如眼睛。现在,该领域开始成熟,并超越这些最初的策略。持续的进步使基因传递更加安全有效,从而在新的组织(如肝脏和心脏)中进行了数十次人体试验。其他方法正在超越基因疗法的最初定义,采用尖端的分子工具来修复基因内的错误,而不是替换或插入整个基因。
然而,尽管最近取得了进展,基因疗法在更广泛的临床应用道路上仍面临许多障碍——其中最主要的是如何在不触发免疫反应的情况下靶向特定组织。更广泛、长期的挑战包括提高生产效率和降低成本:在美国,基因疗法目前的平均治疗费用超过每剂 40 万美元。尽管如此,凭借如此巨大的潜力和如此多需要新解决方案的患者,基因疗法只会继续在知名度和效力方面不断增长。
早期的成功和冲击波
最初的基因疗法方法(其中一些方法仍在应用)背后的概念相当简单:当疾病是由缺失或功能失调的基因引起时,将该基因的功能性副本传递到受影响的细胞中。加州大学圣地亚哥分校的生物工程师普拉尚特·马利说,这是“基因疗法 1.0 版本的定义”。
最早的尝试之一发生在 1990 年,当时美国国立卫生研究院的研究人员治疗了两名患有严重免疫缺陷的年轻女孩,这种免疫缺陷是由酶缺失引起的。在那次试验中,与许多目前的治疗方法一样,产生酶的治疗基因搭乘工程病毒进入靶细胞,这些病毒的大部分基因组已被剥离。这使得病毒无法复制,同时为传递所需的人类基因腾出了空间。杜克大学高级基因组技术中心主任查尔斯·格斯巴赫说,本质上,这种方法利用了病毒感染人类细胞的能力,同时“利用病毒外壳作为特洛伊木马,传递治疗性基因货物”。
美国国立卫生研究院团队抽取了女孩们的一些血液来分离白细胞,然后用携带编码缺失酶基因的病毒“感染”这些白细胞。接下来,该团队将经过纠正的细胞输注到女孩体内。每个孩子在接下来的 18 到 24 个月内接受了大约十几次输注。这种治疗方法并非治愈,但减轻了她们的症状,并证明了该方法可以安全使用。格斯巴赫说,就其本身而言,这是一个“重要的里程碑”。
随后迅速涌现出大量新的基因治疗试验,但在 1999 年,18 岁的杰西·格尔辛格在接受旨在治疗其代谢性肝病的一项实验性基因治疗时去世,该治疗使他的免疫系统过度运转。几年后的 2003 年,研究人员报告称,几名接受免疫缺陷治疗的人患上了白血病,这是病毒随机将其货物插入基因组的促癌区域的不幸结果。
格斯巴赫说,研究人员开始思考,“‘等等,也许我们对它的理解不如我们想象的那么好。’”基因疗法停滞了近十年。临床试验暂停,研究人员将所有注意力重新转向实验室——研究和调整病毒载体,去除额外的基因,并用化学物质处理它们,使其更安全、更有效地到达靶细胞。
重新聚焦为更好地理解什么有效、什么无效提供了时间和空间。今天,由于取得了这些进展,许多基因疗法采用了腺相关病毒 (AAV) 或逆转录病毒载体,除了早期试验中改进的腺病毒载体外,每种载体都有其自身的优点和缺点。大多数 AAV 载体传递的遗传货物作为单独的、自由漂浮的元件保留在细胞内,而不是稳定地整合到宿主细胞的基因组中。这使得这些载体比早期载体诱发癌症的可能性大大降低,但根据治疗基因在宿主细胞中保留的时间长短,可能会使治疗的持久性降低。另一方面,由于它们体积小,因此可以感染范围广泛的细胞并在组织内有效传播。逆转录病毒具有不同的优势。与 AAV 载体相比,它们可以容纳更大、更复杂的基因。而且,一些逆转录病毒,如慢病毒,倾向于将自身插入编码区,即基因组中被翻译成蛋白质的部分。这最大限度地降低了癌症风险,同时比 AAV 载体带来更持久的益处。
领域复苏
基因疗法在 2010 年代初期重新开始,当时宾夕法尼亚州和马里兰州的研究人员分别报告了治疗白血病或淋巴瘤的试验结果。实验性疗法训练并增强了患者的免疫系统,使其能够检测和摧毁癌细胞。为此,科学家们必须设计基因,使细胞能够识别和杀死肿瘤。他们将这些基因放入逆转录病毒载体中,并将它们传递到 T 细胞,即从受试者血液中分离出来的免疫细胞。当经过治疗的 T 细胞被重新输注时,它们使癌症进入缓解期。“一切看起来又非常有希望了,”辛西娅·邓巴说,她是一位在国家心肺血液研究所研究血细胞治疗的医生科学家。
美国食品和药物管理局此后批准了几种此类 T 细胞疗法,称为嵌合抗原受体 (CAR) T 细胞疗法,用于治疗某些淋巴瘤和白血病,以及多发性骨髓瘤。由于 CAR T 细胞治疗本身并不解决基因功能障碍,而是赋予 T 细胞肿瘤追踪能力,因此有些人争论它们是否完全符合基因疗法的资格。然而,从方法论上讲,CAR T 通过使用病毒载体传递基因来增强细胞功能——类似于最早的尝试。“你对‘基因疗法’的定义在边缘上有点模糊,”邓巴说。
另一种在类别边缘有点模糊的基因方法被称为寡核苷酸疗法。该技术不是纠正现有基因,而是使用短核酸序列或寡核苷酸来影响细胞如何将基因翻译成蛋白质。其中一种治疗方法努西内生(Spinraza)与中间 RNA 分子结合,诱骗细胞产生更多在脊髓性肌萎缩症患者中缺失的蛋白质。
基因疗法 2.0
马利说,在过去的十年中,技术进步迎来了一个新时代,基因疗法的定义也在不断发展。最新的方法放弃了健康基因的传递,而是旨在精确修复细胞内的基因。马利说,当基因组中存在突变或其他错误时,现在的问题是,“我们是否真的可以进去修复它?”
这项创新得益于获得诺贝尔奖的 CRISPR-Cas9 的发现,CRISPR-Cas9 是细菌中的一种免疫防御系统,它可以检测入侵病毒的特定 DNA 序列,并引导一种酶切断并摧毁病毒基因组。该系统在细菌之外具有广泛的用途:科学家们发现他们也可以使用它在哺乳动物基因组内进行精确切割。在短短七年内,这项技术已从哺乳动物细胞的体外实验室实验发展到人体试验。
基于 CRISPR 的疗法中的“货物”不是 DNA 片段,而是基因编辑系统本身,通过病毒、纳米颗粒或单独作为 RNA-蛋白质复合物引入细胞。这些疗法可以在体外(体外)使用,在将细胞返回患者之前在实验室中改变细胞,或者通过将基因编辑工具直接发送到受影响的组织,在那里它们编辑细胞基因组。
数十家公司目前正在开发此类基于 CRISPR 的疗法。一项早期临床试验采用了一种体外基因编辑方法来治疗患有镰状细胞病或相关血液疾病(称为 β-地中海贫血)的人。这些研究人员在 2021 年 1 月报告了他们前两名受试者的结果。6 月,另一家公司报告了首次成功的直接基因编辑试验,该试验使用纳米颗粒将 CRISPR-Cas9 组件传递到肝细胞中,并使一种与罕见疾病(称为转甲状腺素蛋白淀粉样变性)相关的基因失活。
新兴方法允许更高的精度和细微差别——例如,交换单个核苷酸,或暂时抑制基因的活性而不改变其 DNA——使研究人员有余地将他们的目标定得更高。他们正在研究神经系统疾病、自身免疫性疾病和其他癌症的治疗方法。从长远来看,他们的目标是从单基因疾病转向治疗由多个基因相互作用引起的疾病,例如心血管疾病和慢性疼痛。随着基因疗法成功缓解了一些疾病,研究人员、临床医生和患者都希望保持过去十年的进展,并将基因疗法确立为现代医学的基石。
编辑生命之书
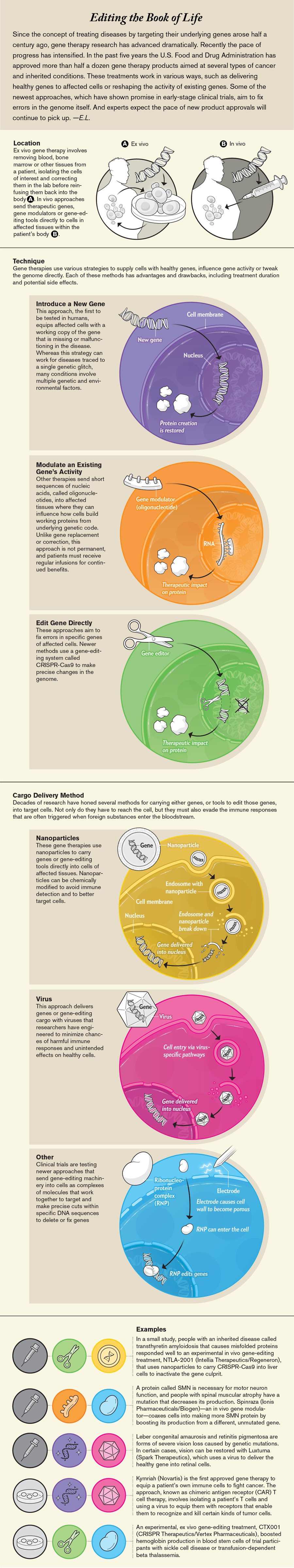
图片来源:Now Medical Studios;来源:“曾经和未来的基因疗法”,作者:Karen Bulaklak 和 Charles Gersbach,发表于《自然通讯》,第 11 卷;2020 年 11 月(参考文献);辛西娅·邓巴美国国立卫生研究院(专家评审)
