大约三十年前,一位名叫大卫·P·斯特拉坎的英国流行病学家提出了一个简单但违反直觉的观点,以解释为什么在过去一个世纪中,花粉热、湿疹和哮喘变得越来越普遍。斯特拉坎将英国这些过敏性疾病发病率的上升与工业革命以来生活水平的提高联系起来——特别是,幼儿时期经历的感染次数急剧下降。他推测,生命最初几年接触细菌和病毒(如果婴儿能存活下来)会在某种程度上预防这些疾病在以后出现。
尽管斯特拉坎最初的直觉,现在通常被称为卫生假说,关注的是过敏性疾病,但研究人员后来也使用其基本原则——接触或缺乏接触环境影响——来解释历史上各种其他疾病的增加。这些疾病包括脊髓灰质炎、多发性硬化症和1型糖尿病。许多流行病学调查揭示了某些疾病模式随着工业化从欧洲蔓延到北美及其他地区而不断升级。凡是儿童期感染(和死亡率)下降的地方,几种以前罕见的疾病的发病率就开始上升——尽管并非均匀地且并非同时发生。
严重的脊髓灰质炎爆发最早出现在19世纪末。多发性硬化症的发病率(免疫系统攻击特定神经细胞周围的保护层)在20世纪下半叶在世界某些地区翻了一番。1型糖尿病(当身体错误地破坏胰腺中产生激素胰岛素的细胞时发生,胰岛素使身体能够利用葡萄糖获取能量)在20世纪上半叶开始缓慢上升,并在1950年代急剧上升。
支持科学新闻事业
如果您喜欢这篇文章,请考虑通过以下方式支持我们屡获殊荣的新闻事业 订阅。通过购买订阅,您正在帮助确保有关塑造我们当今世界的发现和想法的具有影响力的故事的未来。
早期接触各种病毒或细菌如何能预防许多看似无关的疾病的出现,其确切机制仍然不清楚。某种程度上,感染使发育中的身体学会如何应对病原体。此外,缺乏接触这些微生物可能会促使身体攻击自身。特别是,大量研究表明,一大类病原体——肠道病毒——与脊髓灰质炎和1型糖尿病的激增有关。
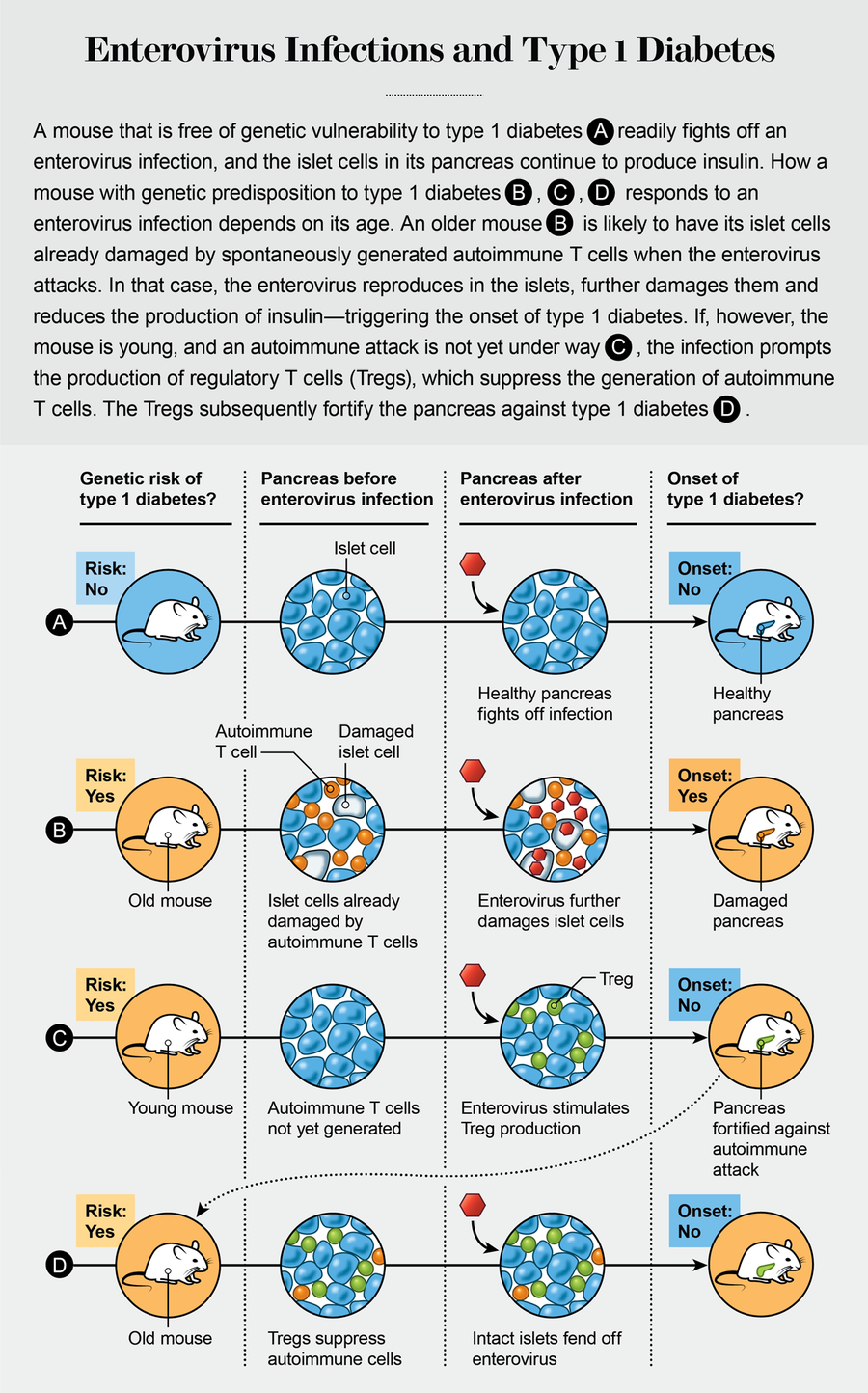
与更常见的2型糖尿病(通常与成年后体重增加有关)不同,1型糖尿病通常在20岁之前发病。我们对容易自发患上1型糖尿病的小鼠进行的实验表明,同一株肠道病毒可以通过复杂的机制来预防或引发该疾病,这取决于小鼠感染时的年龄。假设我们的结果在人类身上得到证实,那么基于一组通常在粪便中排泄的病毒的疫苗有可能预防许多人的1型糖尿病。
一个世纪的线索
我们的研究始于一个基本问题,类似于斯特拉坎提出的问题:为什么1型糖尿病在过去如此罕见,但在1950年代却成为一种祸害?在古代,希腊、阿拉伯、印度和中国的医生都描述了一种罕见的症状群——包括体重迅速下降、异常口渴以及品尝时带有甜味的尿液——这几乎可以肯定是1型糖尿病的结果。研究人员根据个别医院的数据推断,在20世纪初,每10万名15岁以下儿童中约有1到2人患上1型糖尿病。今天,在美国部分地区,这个数字接近每10万名儿童20人,而在芬兰,则超过每10万名儿童60人。令人不安的是,这些数字仍在继续上升。
然而,这种增长并非稳步上升。在一些国家缓慢上升多年之后,1型糖尿病在20世纪中叶开始飙升。从那时起,流行病学家计算出全球平均每年增长3%到5%。在1998年至2010年间,1型糖尿病的发病率惊人地跃升了40%。
如此短的时间内如此急剧的上升告诉我们,我们看到的不是人类基因库的根本变化:DNA不会如此迅速地突变。许多基因的不同组合深刻地增加了个体患上1型糖尿病的风险。然而,据研究人员所知,这些高风险基因谱的流行率并没有改变。相反,越来越多具有相对较低1型糖尿病遗传易感性的人现在正在遭受这种疾病的折磨。很少有病例可以完全归因于遗传疾病。来自世界各地科学家的这些和其他发现强烈表明,新出现的环境因素必然在起作用。
多年来,人们考虑过各种可能性——但都被驳回了。与2型糖尿病不同,1型糖尿病不能由人的饮食或其他与健康相关的习惯引起。更令人感兴趣的是,几项研究确定,1型糖尿病在离赤道越远的地方发生频率越高。维生素D的缺乏是否可能是这种区域差异的原因?维生素D很容易在身体暴露在阳光下时产生。然而,这个想法很快就被推翻了。例如,流行病学家发现,芬兰等一些最北端的国家,在阳光较多的地区比阳光较少的地区1型糖尿病的发病率更高。
大量证据反而指向病毒触发因素——可能是一种或多种存在于污水或受污染饮用水中的病毒。大量研究表明,肠道病毒——之所以如此命名是因为它们通常存在于肠道中(古希腊语中énteron的意思是肠)——是罪魁祸首。(事实上,没有实质性数据将任何其他类型的病毒或环境影响与该疾病联系起来。)一些肠道病毒能够在胰腺中复制,炎症区域与产生胰岛素的胰岛细胞所在的区域相邻。炎症区域产生自身免疫性T细胞。在正常情况下,我们的T细胞保护身体免受入侵者的侵害。然而,自身免疫性T细胞会攻击身体自身的胰岛细胞,破坏它们产生胰岛素的能力,从而导致糖尿病。
研究人员已经统计出100多种肠道病毒。然而,似乎没有单一类型的肠道病毒单独负责在全球范围内引发糖尿病。相反,科学家们已经确定了一些候选病毒,其中最主要的是六种被称为柯萨奇B组病毒的肠道病毒,它们与该疾病的发生有关。他们不完全理解这种感染如何可能促使身体攻击自身。这个过程必然是复杂的:流行病学研究表明,某些似乎会促进某些人患上该疾病的特定肠道病毒,显然可以保护另一些人免于患上该疾病。
图片来源:Amanda Montañez
污水
当我们评估可能识别出导致糖尿病的肠道病毒的各种实验时,我们从另一种疾病中寻找线索:脊髓灰质炎。脊髓灰质炎是一种通常导致儿童瘫痪的疾病,它是由另一类肠道病毒——脊髓灰质炎病毒引起的。这些病毒似乎已经存在了数千年:一块古埃及石碑(一块刻在石板上的浮雕),现在在哥本哈根博物馆展出,似乎描绘了一位脊髓灰质炎患者。然而,它们引起的这种可怕的疾病过去非常罕见,直到19世纪末,零星的和随后的年度流行病突然开始发生。在20世纪,脊髓灰质炎夺走了数万名儿童的生命,并使数百万儿童致残。就在1988年,脊髓灰质炎每天使约1000名儿童致残。得益于大规模疫苗接种运动,脊髓灰质炎现在仅在两个国家流行。
卫生假说有助于解释脊髓灰质炎病例的这种突然激增。人们很容易忘记,发达国家当代生活的许多便利设施只有大约一个世纪的历史。在欧洲和北美广泛安装市政供水系统之前,人们从井、池塘或公共喷泉取水用于所有目的,包括饮用、洗澡和洗衣服。毫不奇怪,饮用水经常被人类或动物粪便污染。自来水和肥皂的缺乏也意味着人们在如厕后无法像今天这样严格地保持双手清洁。因此,简单的准备饭菜或握手的行为可能会广泛传播细菌。
因此,几乎每个人,从生命早期开始,都暴露于从人类粪便传播到环境中的脊髓灰质炎病毒。然而,新生儿往往不会患上这种疾病,因为他们的母亲已经对病毒产生了免疫力,并将保护性抗体传递给怀孕期间发育中的胎儿和哺乳期间的婴儿。随着婴儿长大并停止哺乳,并且随着母体抗体减弱,幼儿开始由于反复接触病毒而产生自身针对该病毒的保护性抗体。因此,尽管脊髓灰质炎病毒几乎无处不在,但脊髓灰质炎本身并不常见,因为年轻人首先受到母亲抗体的保护,随后又受到自身免疫系统的保护。
这种保护链,作为人类生活的一部分已存在亿万年,随着人类群体进入一个“更清洁”的世界而开始断裂。一个可能幸免于接触脊髓灰质炎病毒的男孩可能会在以后的生活中遇到它们,那时他没有任何保护性免疫力。这种与脊髓灰质炎病毒的偶然相遇可能会导致麻痹性脊髓灰质炎——每100到200例脊髓灰质炎病毒感染中发生一次。这可能就是为什么例如富兰克林·D·罗斯福总统在加拿大新不伦瑞克省的一个岛屿度假时,在39岁时患上麻痹性脊髓灰质炎。
尽管脊髓灰质炎留下了可怕的遗产,但我们从以下事实中获得了一些安慰:针对引起脊髓灰质炎的病毒感染的疫苗已被证明是安全且非常有效的。如果研究人员可以制造出针对一种肠道病毒的疫苗,他们也应该能够制造出针对其他肠道病毒的疫苗。如果实验证明肠道病毒会导致1型糖尿病,那么这一发现可能会指向一种潜在的新疗法:即,一种针对1型糖尿病的疫苗,该疫苗将保护那些风险最高的人免受病毒感染。
(我们可以排除脊髓灰质炎病毒作为1型糖尿病的病因。尽管脊髓灰质炎流行病在20世纪变得司空见惯,但没有观察到1型糖尿病的平行爆发。此外,脊髓灰质炎已在1型糖尿病发病率持续上升的国家被根除。)
为了证明病毒会引起特定疾病,应该首先从受影响的组织中分离出病毒。对于1型糖尿病,那就是胰腺。但是安全地从人类胰腺中取样组织仍然是一项外科挑战——这就是为什么很少对其他方面健康的人进行这种活检的原因。此外,要准确确定身体免疫系统何时开始攻击胰腺并破坏产生胰岛素的胰岛细胞极其困难。当明确某人患有1型糖尿病时,任何可能是活动性感染迹象的迹象通常都已消失。
然而,大约40份已发表的报告令人信服地将各种肠道病毒的存在与1型糖尿病的发生联系起来:病毒或其遗传物质是从患者的死后胰腺组织中分离出来的。其他研究表明,某种肠道病毒感染很可能在1型糖尿病的发展中起着长期作用。
碰巧的是,一种特定的小鼠品系,即非肥胖型糖尿病 (NOD) 小鼠,会在没有任何研究人员干预的情况下自行患上1型糖尿病。(奇怪的是,在卫生条件下饲养的NOD小鼠比在肮脏笼子中饲养的小鼠患病速度更快。)我们假设NOD小鼠类似于具有1型糖尿病遗传易感性的人类。此外,与大多数肠道病毒不同,柯萨奇B组病毒在小鼠体内复制良好,并且已经与1型糖尿病联系起来。所有这些因素使NOD小鼠成为探索肠道病毒与1型糖尿病之间关系的理想模型。
2002年,我们有意用柯萨奇B组病毒感染非常年轻的NOD小鼠,这些小鼠原本是在无菌环境中饲养的。我们发现,与未感染的对照组相比,这些动物随着年龄增长而患上1型糖尿病的可能性要小得多。这些结果支持了早期接触微生物对预防1型糖尿病具有保护作用的假设。有趣的是,这种影响并不局限于特定类型的柯萨奇B组病毒,尽管某些病毒似乎比其他病毒提供更强的保护作用。芬兰坦佩雷大学病毒学家海基·许奥蒂及其同事的实验也产生了类似的结果。
我们可以考虑三种可能的机制,通过这些机制,幼年时接触肠道病毒可以预防此类感染在以后的生活中造成的损害。首先,感染可能会触发针对该特定类型肠道病毒的保护性抗体的产生,因此随后接触相同类型不会导致疾病。(这个过程反映了脊髓灰质炎病毒疫苗和我们今天使用的许多其他病毒疫苗背后的原理。)其次,由于柯萨奇B组病毒在分子水平上与其他肠道病毒非常相似,它们可能会促使身体更快地动员足够的防御力量,即使是针对它从未遇到过的肠道病毒。第三,肠道病毒感染可能会刺激称为Tregs的调节性免疫细胞的产生。这些通常有益的细胞充当尽职尽责的警察部队,抑制否则会伤害宿主的自身免疫性T细胞。
为了区分这些不同的机制,我们决定在不同年龄感染小鼠,并在接种后观察至少30周。经过多年的实验,我们发现用柯萨奇B组病毒感染年龄较大的NOD小鼠会增加而不是降低它们患上1型糖尿病的可能性。这一发现与我们在年轻NOD小鼠中观察到的情况形成鲜明对比。
我们得出结论,胰腺必须已经发炎——这意味着产生胰岛素的胰岛细胞必须首先受到小鼠自身自身免疫性T细胞的攻击——肠道病毒才能进入胰岛并繁殖,从而加速糖尿病的发病。换句话说,在柯萨奇B组病毒感染可能加速1型糖尿病发病之前,必须先发生基因诱导的对胰腺的自身免疫攻击。小鼠年龄越大,炎症越严重,疾病发作得就越快——通常会在一两天内导致完全爆发的糖尿病。(相比之下,在无菌环境中饲养的年龄较大的小鼠在几周后才患上糖尿病。)
加利福尼亚州拉霍亚免疫学研究所的免疫学家马蒂亚斯·冯·赫拉斯及其同事的研究表明,生命早期(在自身免疫攻击开始之前)的肠道病毒感染可以刺激调节性T细胞的产生,这些细胞会持续到成年期。Tregs抑制自身免疫性T细胞的产生,从而预防1型糖尿病。但是,如果胰腺已经因自身免疫性T细胞而发炎——就像在年龄较大的NOD小鼠中自然发生的那样——病毒就能够复制,损害产生胰岛素的胰岛细胞并引发糖尿病。换句话说,肠道病毒既可以预防也可以引发NOD小鼠的1型糖尿病,这取决于感染发生的年龄。
糖尿病疫苗
假设在NOD小鼠身上的这些观察结果反映了具有1型糖尿病遗传易感性的人类的情况,我们如何利用它们来帮助这些脆弱的个体?没有人希望回到卫生习惯不良或没有卫生习惯的日子。但我们不应该必须这样做。根据我们在脊髓灰质炎病毒疫苗方面的经验,我们知道开发安全有效的肠道病毒疫苗是可行的。
一般来说,抗病毒疫苗有三种类型:活但减毒、灭活和亚单位疫苗。活的、减毒的疫苗最初是通过将病毒通过细胞或动物宿主来减弱其致病能力而产生的。这种疫苗被认为是诱导免疫力最有效的疫苗,因为病毒在宿主体内复制并诱导正常的免疫反应。但它们可能会迅速突变成致病性毒株。基因工程现在可以改变或删除病毒基因组的特定区域,以限制这种逆转的可能性,但风险仍然存在。灭活疫苗使病毒失活,使其无法繁殖,但它们仍然会在宿主体内诱导一定程度的免疫力。然而,由于病毒不会在体内持续存在,因此通常需要定期重新接种疫苗。亚单位疫苗使用一种或多种已知能刺激免疫反应的病毒部分,以在接种疫苗的人体内产生所需的免疫类型。2021年,针对SARS-CoV-2的mRNA疫苗被部署用于对抗COVID大流行,并显示出优异的效果,在接种疫苗的人群中诱导了保护性免疫。鉴于这种成功,这项技术在不久的将来将很容易适应其他疫苗靶点,例如人类肠道病毒,以预防感染,以及可能预防1型糖尿病。
大量证据表明,没有单一的肠道病毒,甚至少数几种肠道病毒参与了全世界1型糖尿病的发生。此外,历史证据表明,当接触多种肠道病毒是生活常态时,1型糖尿病是罕见的。因此,我们假设接种多种类型的肠道病毒应该提供最大的保护。这种方法将模拟人类过去在整个历史中积累对肠道病毒的保护性免疫的方式。最初的疫苗可以是灭活病毒疫苗,以安全地诱导免疫。此后,可以使用灭活或高度减毒的疫苗作为加强剂量。
我们感到鼓舞的是,针对1型糖尿病的疫苗方法终于正在进行中。许奥蒂的研究小组正在与芬兰生物制药公司Vactech Oy合作开发针对单一类型柯萨奇B组病毒的疫苗,许奥蒂是该公司的董事会主席,并且已经测试了该疫苗预防小鼠1型糖尿病的能力。这种灭活病毒疫苗在人体中的1期临床试验于2021年开始。在儿童身上进行测试——以确保安全性、产生对肠道病毒的保护性免疫反应以及预防1型糖尿病——将需要十年以上的时间。鉴于许多观察表明没有单一毒株的肠道病毒与1型糖尿病有关,我们只能保持希望,希望这种疫苗将显著降低该疾病的发病率。
此外,许多非凡的努力正在进行中,以逆转1型糖尿病的发病。波士顿儿童医院的研究员保罗·菲奥里纳及其同事已经证明,适当处理的干细胞在注入小鼠体内时,有时可以逆转1型糖尿病。另一个由马萨诸塞州总医院免疫生物学实验室的丹尼斯·福斯特曼领导的研究小组正在调查卡介苗 (BCG) 疫苗(通常用于预防肺结核)在消除1型糖尿病影响方面的功效。美国和英国的几个研究小组专注于使用胰岛素原(胰岛素的前体)或编码胰岛素原的DNA进行免疫。特别是,伦敦国王学院的马克·皮克曼及其同事在2017年发布的一份多研究员合作报告表明,来自胰岛素原的蛋白质片段可以在新诊断出1型糖尿病的人群中诱导有益反应。
仅在美国,医生每年就诊断出64,000例新的1型糖尿病病例。我们需要记住,疫苗不可能完全根除该疾病:一些病例似乎仅仅是因为患者的基因构成而发生的。改进治疗方法以提高那些无法再自行产生胰岛素的个体的生活质量仍然很重要。即使只有一小部分疫苗试验参与者免受该疾病的侵害,也将有大量人群拥有更好的生活。鉴于1型糖尿病的发病率正在如此迅速地增加,使其像过去一样罕见的能力可能会使数百万人受益。
