
以下文章经在线出版物《 对话 》许可转载,该出版物报道最新研究。
哇…外面真冷!孩子们涌向电视机,希望听到会放雪假的消息;杂货店的面包和牛奶货架空了,因为一场即将到来的暴风雪;而公用事业卡车正在路上喷洒盐或盐水。
关于支持科学新闻
如果您喜欢这篇文章,请考虑通过以下方式支持我们屡获殊荣的新闻报道: 订阅。通过购买订阅,您正在帮助确保未来能够继续讲述关于发现和塑造我们当今世界的想法的具有影响力的故事。
我们都知道为什么前两个会发生——孩子们为放假一天感到兴奋,可以喝热巧克力和堆雪人。成年人正在囤积必需品。但是那些卡车是怎么回事?
它们正在通过喷洒岩盐或盐水溶液来防止结冰,从而保护驾驶员免受湿滑路面的影响。这种盐与您餐桌上的盐非常相似——都是氯化钠 (NaCl)。有些专有混合物含有其他盐类——例如氯化钾 (KCl) 和氯化镁 (MgCl)——但它们不常用。
道路盐不像您在食物中使用的盐那样纯净;它呈棕灰色,主要是由于矿物质污染。通过径流使环境暴露于这种盐可能会产生一些意想不到的后果,包括对植物、水生动物和湿地的负面影响。
但由于一个简单的科学原理:溶液的凝固点降低,这是一种廉价有效的方法来保护道路免受冰冻。纯水的凝固点,即它变成冰的温度,是华氏 32 度。因此,如果下雪、雨夹雪或冻雨,并且地面温度为华氏 32 度或更低,则街道和人行道上会形成固体冰。
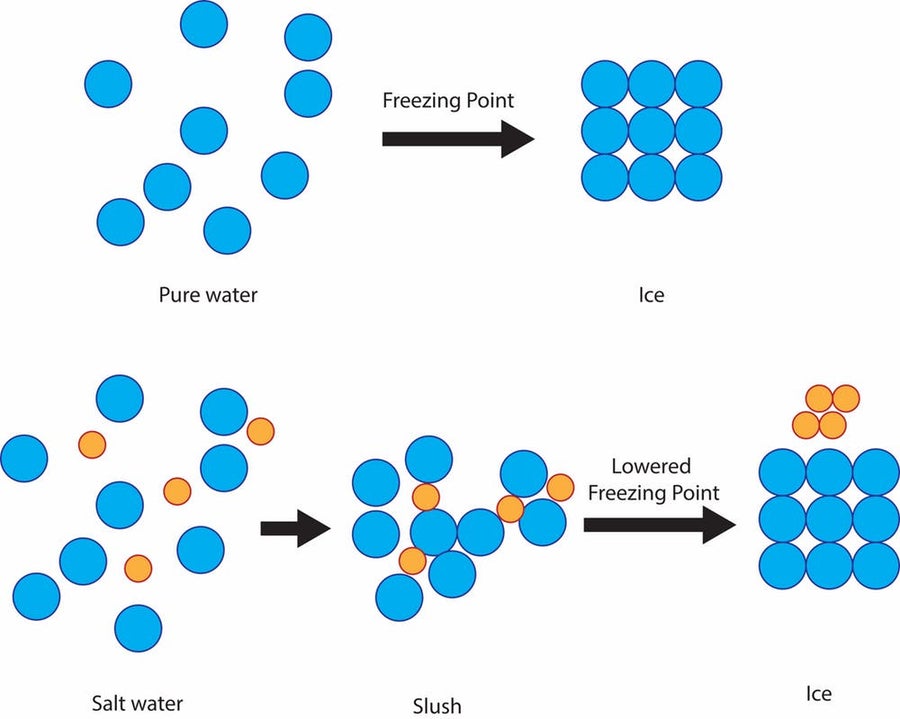
盐可以防止水分子在华氏 32 度时凝固成冰晶,而是在该温度下保持泥泞状,然后最终在华氏 15 度左右结冰。鸣谢:Julie Pollock (CC BY-ND)
但是,如果水中混合了盐,溶液的凝固温度将低于华氏 32 度。盐会阻碍水分子形成固体冰晶的能力。凝固点降低的程度取决于溶液的盐度。
重要的是要注意,盐必须在液态水中才能遵守这一原理。这就是为什么许多城市在结冰之前喷洒盐溶液的原因。
倾倒在冰上的盐依赖于阳光或汽车轮胎驶过产生的摩擦力,以最初将冰融化成可以与盐混合的泥浆,然后不会再次结冰。用固体盐进行预处理依赖于较温暖的路面来最初融化任何积雪或冻雨,以便它可以与盐充分混合。这也是为什么桥梁(比其他道路更冷)的预处理通常不起作用,以及为什么您会看到“桥梁先于道路结冰”标志的原因。
这些盐溶液将水的凝固温度降低到华氏 15 度左右。因此,对于那些面临真正寒冷气温的人们来说,不幸的是,用盐处理并不能消除道路上的冰。
在这些较低温度下使用的另一种策略是在冰上撒沙子。沙子不会改变熔化温度,它只是为您的轮胎提供粗糙的表面,以防止打滑和滑动。
凝固点降低的科学可以应用于任何溶液,许多研究小组都专注于开发对环境负面影响较小的替代品。它们包括糖蜜和甜菜汁等添加剂。因此,也许您可以期待在冬季散步后,不仅可以清理掉牛仔裤底部的白色盐渍,还可以清理掉粉红色的盐渍。
