奥密克戎冠状病毒变异株可能是人类历史上传播速度最快的病毒。一个人感染麻疹病毒——一种传染性极强的微生物——可能在12天内感染另外15人。但是,当奥密克戎在去年冬天突然来袭时,它在人与人之间传播得如此之快,以至于一个病例可能在四天后引起六个病例,八天后引起36个病例,12天后引起216个病例。到二月底,该变异株几乎占美国所有新增新冠感染病例。
早在2020年11月发现阿尔法变异株时,科学家们对其少数突变将如何影响其行为知之甚少。现在,凭借一年的知识和数据积累,研究人员已经能够将奥密克戎的约50个左右的突变与帮助其如此快速有效地传播的机制联系起来。不列颠哥伦比亚大学的生物化学家斯里拉姆·苏布拉马尼亚姆说,这种调查过程通常需要更长的时间。“但是我们已经研究这些变异株一年了,所以我们已经做好了准备,”他补充道。
奥密克戎的突变数量是其他受关注变异株的两倍,其BA.2亚谱系可能具有更多突变。奥密克戎的刺突蛋白上有13个突变,这些突变在其他变异株中很少见。这些对其构造的改变赋予了它新的、令人惊讶的能力。如果说德尔塔是蛮力十足的绿巨人变异株,那么可以将奥密克戎视为闪电侠——戴着面具且速度极快。
支持科学新闻报道
如果您喜欢这篇文章,请考虑通过以下方式支持我们屡获殊荣的新闻报道 订阅。通过购买订阅,您正在帮助确保有关塑造我们当今世界的发现和想法的具有影响力的故事的未来。
在这里,我们探讨该变异株发生物理变化的四种方式。其中三个改变帮助这种病毒逃避免疫系统并变得更具传染性,而第四个改变可能导致其产生更轻微的疾病。
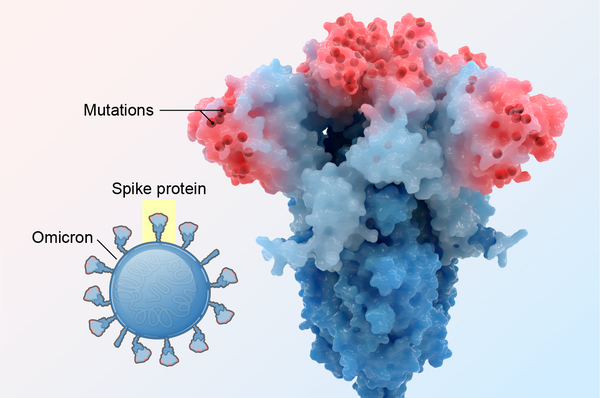
图片来源:Veronica Falconieri Hays
它戴上了伪装。大多数证据表明,奥密克戎之所以具有如此强的传播性,最主要的原因是一种强大的机制:在所有变异株中,奥密克戎具有无与伦比的躲避免疫系统的能力。
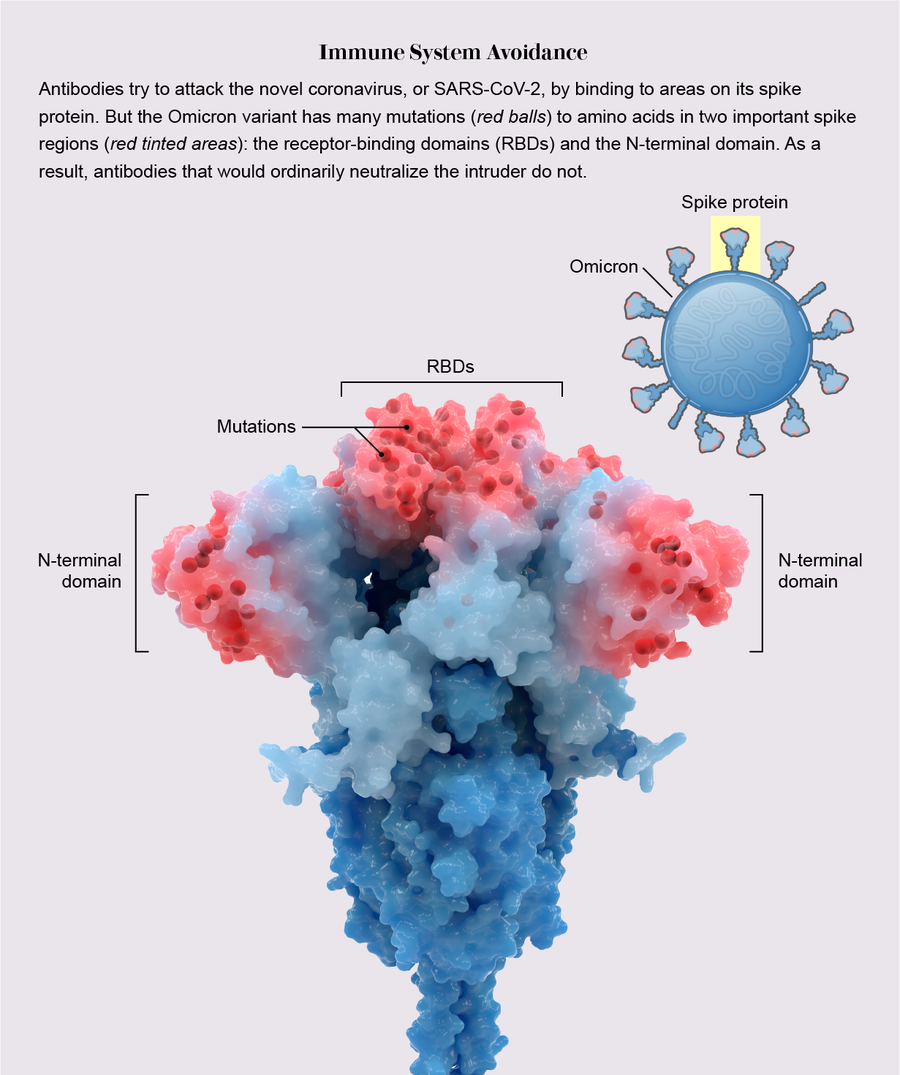
在感染期间,冠状病毒刺突蛋白顶部的拳头状氨基酸团块,称为受体结合域(RBD),会抓住某些人类细胞外部的一种蛋白质:ACE2受体。为了防止这种不幸的结合,免疫系统会产生抗体——由先前感染或疫苗接种诱导产生的Y形蛋白质——这些抗体识别RBD并像尼龙搭扣一样粘附在其上,从而阻碍病毒与ACE2连接。
在之前的变异株中,RBD上的一个、两个或最多三个氨基酸发生了突变,仅足以改变每个RBD,从而阻止部分但不是全部抗体识别它。但是,奥密克戎携带了15个RBD突变,其中许多突变发生在主要的抗体结合位点上,形成了精巧的伪装,以躲避更多的抗体。这就像病毒戴上了全面的《碟中谍》风格的乳胶面具来改变它的面孔。“突变实在太多了,而且新突变也很多,”华盛顿大学的生物化学家马修·麦卡勒姆说。
图片来源:Veronica Falconieri Hays
在《科学》杂志上发表的一项分析中,麦卡勒姆与他的实验室负责人大卫·维斯勒及其同事展示了这种剧烈转化的后果:在医院使用的八种新冠抗体疗法中,只有一种——这些疗法基于天然抗体——仍然能有效地与RBD结合。其他研究表明,RBD和一个名为N端结构域的第二个位点上的突变使病毒能够躲避通过疫苗接种或感染获得的抗体。由于奥密克戎令人信服的伪装,该变异株几乎没有受到阻碍,并以闪电般的速度传播。然而,疫苗仍然可以抵御重症,特别是加强针。
它变得更稳定了。当奥密克戎剧烈改变其刺突蛋白以躲避免疫系统时,这些改变消除了一些刺突蛋白连接ACE2所需的化学残基。但其他突变弥补了这一点:根据《科学》杂志的另一项研究,RBD形成了新的化学桥梁,仍然可以有效地与该蛋白质结合。“它显然失去了一些对结合重要的残基,但它通过其他相互作用弥补了这些残基,”该论文的资深作者苏布拉马尼亚姆说。
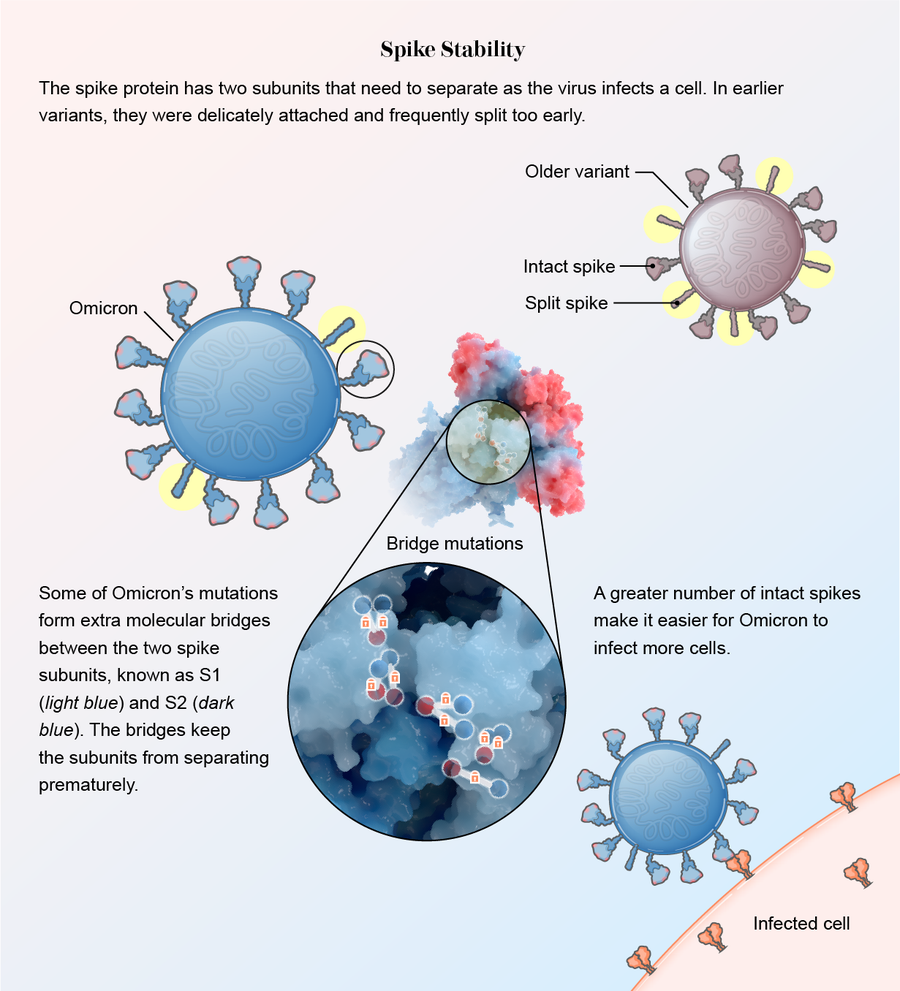
刺突蛋白也变得更坚固。在其他变异株中,刺突蛋白内的两个亚基S1和S2连接松散。这使得它们可以快速分离,以便当病毒遇到人类细胞时,刺突蛋白可以埋入其中。然而,这种脆弱安排的缺点是,许多刺突蛋白过早分离,在接近细胞之前就已分离。一旦分离,刺突蛋白就无法再帮助病毒附着。
图片来源:Veronica Falconieri Hays
根据几项研究,奥密克戎的突变导致细小的分子桥梁更好地将亚基连接在一起。其中一项研究发表在《医学病毒学杂志》上,其他研究以预印本论文的形式发布,尚未经过其他科学家的正式审查。“这种病毒确实保护了自己免于过早触发,”其中一篇论文的作者、俄亥俄州立大学病毒和新兴病原体项目主任刘善绿说。“当病毒在正确的时间出现在正确的位置时,它可以被触发并进入细胞,但在此之前不会。”
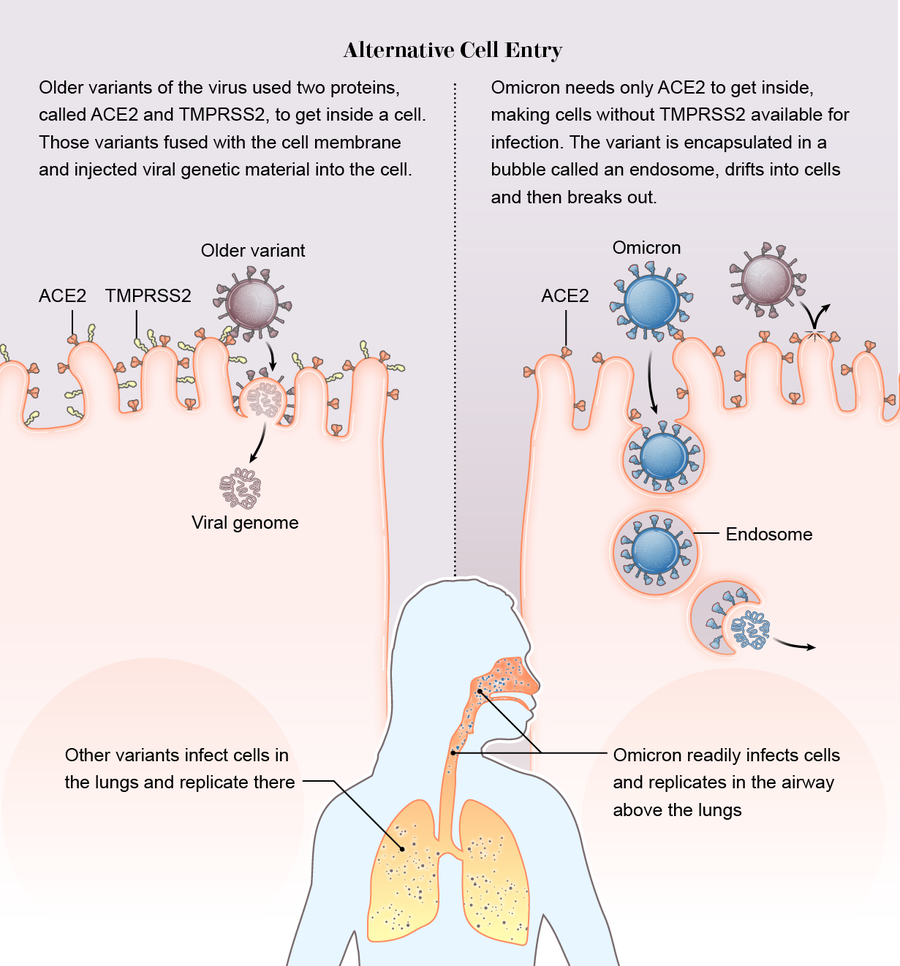
它从侧门溜了进去。在之前的变异株中,有一个不变的因素:病毒依赖于人类细胞表面上的一种名为TMPRSS2(发音为“tempress two”)的蛋白质来帮助其突破细胞膜。但是奥密克戎没有使用TMPRSS2。它采取了完全不同的途径进入细胞。它没有破坏前门,而是从侧门溜了进去。
其他变异株需要ACE2和TMPRSS2蛋白质才能将它们的基因组注入细胞,而奥密克戎仅与ACE2结合。然后它被包裹在一个称为内吞体的空心气泡中。气泡漂移到细胞内,病毒在那里突破并开始接管。
科学家们推测,奥密克戎通过这种方式获得了两个可能的优势。首先,许多细胞的外部没有TMPRSS2,因此如果病毒不需要表面蛋白质,它就有更广泛的细胞可供感染。“目前的假设是,如果病毒通过内吞体进入并且不依赖TMPRSS2,那么病毒可利用的细胞可能会多出七倍甚至十倍,”伦敦帝国学院的病毒学家温迪·巴克利说,她的团队和其他团队一起检测到新的进入途径,他们在预印本中对此进行了描述。
其次,虽然德尔塔变异株经常深入感染富含TMPRSS2的肺细胞,但奥密克戎在肺部上方的气道中快速复制,这可能有助于它在人与人之间传播。“我们可能看到了一种向呼吸道上部的转变,这促进了病毒通过咳嗽、打喷嚏等方式传播,”格拉斯哥大学的病毒学家乔·格罗夫说,他也是一篇预印本的合著者,该预印本也检测到了进入途径的变化。
它降低了防御能力。与前三个变化不同,奥密克戎的最后一个,第四个变化并没有帮助该变异株更具传染性。相反,这种改变产生了一个令人惊讶的弱点,使该变异株更容易受到我们身体防御系统的一部分的攻击,即先天免疫系统。
科学家们检查了奥密克戎和德尔塔对干扰素的反应,干扰素是一种小蛋白质,其作用类似于高速公路照明弹,提醒先天免疫细胞注意入侵者。德尔塔擅长抑制干扰素反应,但奥密克戎却很糟糕。它实际上激活了干扰素信号传导。
研究人员尚不清楚这种变化是如何发生的。冠状病毒的26种蛋白质中至少有11种与干扰素系统相互作用,其中许多在奥密克戎中发生了突变。但是,即使不知道确切的机制,科学家们也可以看到这种变化后果的迹象。
由于肺部的干扰素反应比上呼吸道更明显,奥密克戎对该反应的脆弱性可能阻止了它扩散到更深层的器官。“这在生物学上符合我们所看到的,”英国肯特大学的生物学家马丁·迈克尔斯说,他在一篇发表在《细胞研究》杂志上的论文中分析了奥密克戎如何与干扰素相互作用。“奥密克戎似乎不太能够进一步进入身体和肺部,从而引起重症。”
虽然奥密克戎对我们整个人群的影响并不轻微——它导致住院和死亡人数激增,以及创纪录的儿童住院人数——但该变异株似乎确实在一些感染者以及动物模型中引起了较轻的疾病。然而,未接种疫苗或有其他风险因素的人仍然面临着重病和死亡的高度风险。
未来的变异株,如果出现的话,可能会对其结构和能力进行其他修改。“我不相信我们可以高枕无忧,并说一切都结束了,”巴克利说。随着感染在世界各地的许多人群中持续传播和演变,病毒将想出更多传播方式——包括科学家们甚至没有想到的方式。