本文是“镰状细胞病创新”专题报道的一部分,该报道由编辑独立完成,并获得了Vertex Pharmaceuticals的资助。
镰状细胞病似乎很简单:它是由单个基因中的单个突变引起的。但它对患者的影响却非常复杂——如此复杂,以至于在该突变被发现 70 年后,治疗仍然困难。在拥有健康红细胞的人体内,血红蛋白蛋白质在细胞在全身循环时携带氧气。在镰状细胞病患者中,当突变的血红蛋白蛋白质聚集成纤维时,就会形成同名的镰状细胞,使红细胞通常的碟形形状变形为弯曲的镰刀状,从而阻止它们有效地向组织输送氧气。这些镰状细胞可能会卡在血管内,中断血液流动,并经常引发剧烈疼痛和危象,严重时会导致患者住院,并使其面临心力衰竭和其他危及生命的风险。从长远来看,血液流动中断、氧化应激和炎症共同导致中风以及对血管和其他器官的永久性损害。
该疾病的侵袭方式如此之多,研究人员正从多个角度着手解决这个问题:从源头上阻止骨髓首先产生突变的红细胞;在细胞水平上,通过改变畸形红细胞的代谢和蛋白质结构;以及在免疫水平上,预防长期器官损伤。“问题是[它]们都是相互关联的,”杜克大学血液学家玛丽莲·特伦说。“那么你在哪里筑坝呢?”
支持科学新闻业
如果您喜欢这篇文章,请考虑通过以下方式支持我们屡获殊荣的新闻报道 订阅。 通过购买订阅,您将帮助确保有关当今塑造我们世界的发现和想法的具有影响力的故事的未来。
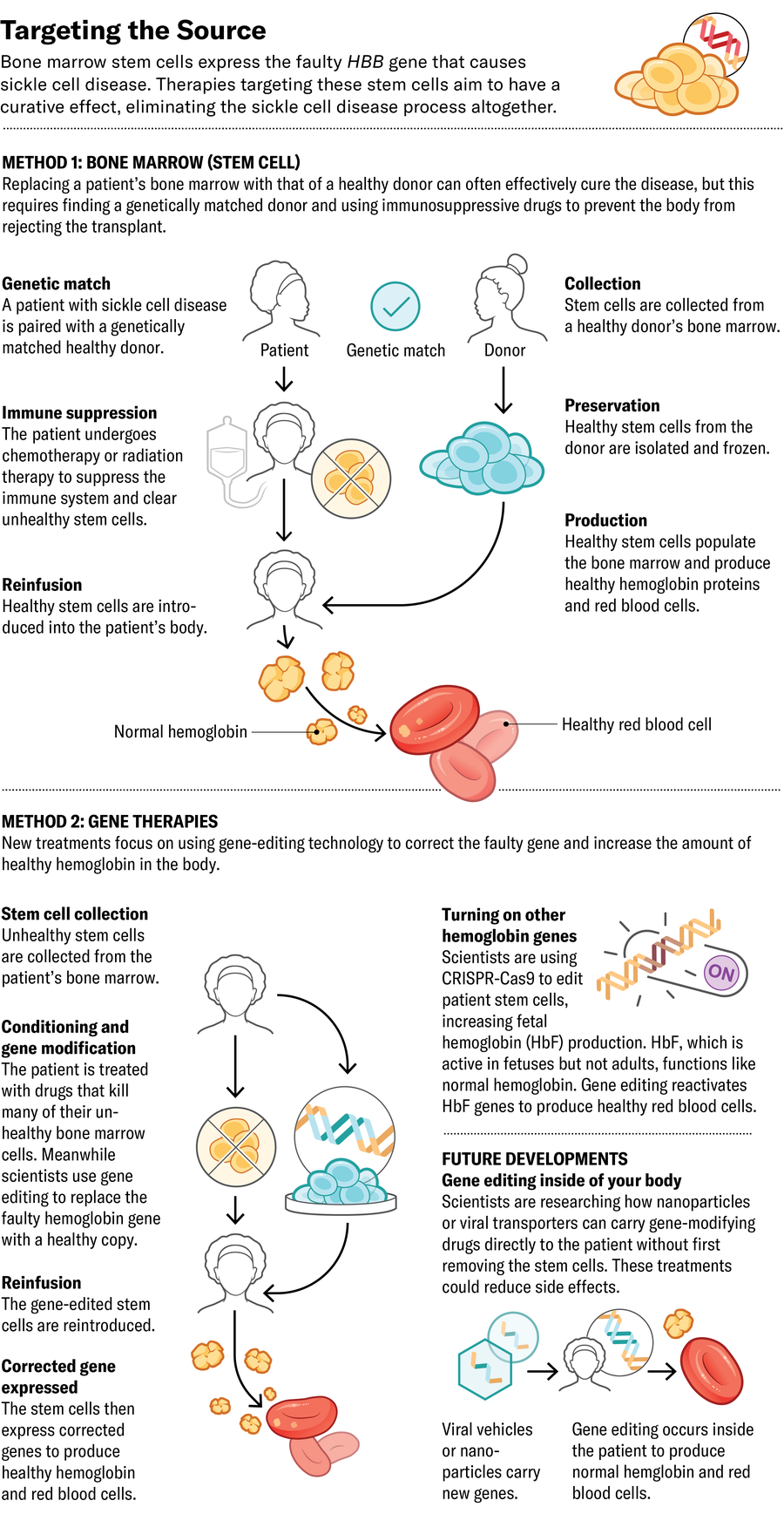
理想的阻止疾病的地方是在其源头:如果骨髓干细胞正在生成有缺陷的红细胞,则用产生健康细胞的干细胞替换它们。这种方法最成熟的方法是来自匹配供体的骨髓移植。该手术需要使用强力化疗预先消除患者的原始骨髓细胞,以便为引入的细胞生长创造一个空间。这种治疗可能导致不孕,并且需要长期服用免疫抑制药物——通常持续数年——以防止身体排斥移植。

Now Medical Studios;来源:美国血液学协会首席科学官凯莉·罗斯(顾问)
为了改进骨髓移植的成功率,一些公司创造了基因编辑方法,消除了对免疫抑制药物的需求。他们取出患者的干细胞,在实验室中修改细胞的 DNA 以促进健康血红蛋白的产生,然后将它们重新引入患者体内。许多此类基因修饰方法已经进入临床试验或已获得美国食品和药物管理局的批准。
婴儿出生时产生的血红蛋白形式,称为胎儿血红蛋白 (HbF),不受镰状突变的影响。通常,HbF 在出生后几个月内大部分会被成人版本的血红蛋白取代,这促使几家公司专注于增加血液中 HbF 的含量。2023 年,FDA 批准了 Vertex Pharmaceuticals 的 exa-cel,该药物使用 CRISPR-Cas9 基因编辑技术来停用阻止 HbF 产生的基因。结果是更高的胎儿血红蛋白与成人血红蛋白的比率。
Editas Medicine 也在增强 HbF 的产生,使用另一种称为 Cas12a 的 CRISPR 相关酶进行编辑。Cas9 通过在双螺旋的同一位置断开两条链来编辑 DNA,而 Cas12a 在不同位置断开它们,并产生更一致的编辑。Beam Therapeutics 正在寻求类似的方法,使用另一种形式的 CRISPR 来交换遗传密码中的单个核苷酸,从而增强 HbF 的产生。这两种疗法都仍在临床试验中。
Now Medical Studios;来源:美国血液学协会首席科学官凯莉·罗斯(顾问)
另一种不同的策略是插入更具弹性的成人血红蛋白编码基因版本,而不是增加 HbF。Bluebird bio 的 lovo-cel 也于去年获得 FDA 批准,它使用更经典的基因治疗方法。它不是编辑患者的 DNA,而是使用一种改良的病毒将健康、增强的成人血红蛋白基因副本传递到骨髓干细胞中,在那里它整合到患者的 DNA 中。
费城儿童医院的儿科血液学家 Alexis Thompson 说,这些新技术“与我们几乎无法为家庭提供帮助的多年和几十年相比,是一种进步。”
未来的一种方法可能让医生在不从体内取出骨髓的情况下编辑患者的骨髓。在去年发表在《科学》杂志上的一项研究中,研究人员描述了将信使 RNA (mRNA) 携带到骨髓干细胞中的纳米粒子的开发。当他们在镰状细胞病患者的细胞中使用这些粒子时,mRNA 编码的编辑系统成功地修改了这些细胞基因组中的血红蛋白基因,以产生更多健康的血红蛋白蛋白质。
特伦说,这种体内技术可能需要 10 到 20 年才能准备好进行大规模人体试验。“我们知道我们需要的技术。我们知道很多部件。我们只是还没有能够让它们协同工作。”
与此同时,当前的基因疗法仍然昂贵且难以扩大规模,因为每个患者的细胞批次都必须单独编辑。这些疗法对于大多数患有该疾病的人来说遥不可及,尤其是在撒哈拉以南非洲地区,那里发生了 75% 的镰状细胞病例。
Now Medical Studios;来源:美国血液学协会首席科学官凯莉·罗斯(顾问)
所有这一切都意味着,对于大多数人来说,最容易获得的根治性治疗方法是来自具有特定、基因匹配的细胞标记的供体的骨髓移植。(这种匹配通常但不总是能在近亲家庭成员中找到。)现在,一种最初为治疗血癌而开发的技术可以通过扩大供体库使更多移植成为可能。一种包括短暂疗程的两种化疗药物——噻替哌和环磷酰胺——的策略足以抑制骨髓接受者的免疫系统,使其能够接受几乎任何与其共享一半 DNA 的供体的移植,例如没有镰状细胞病的父母、表亲或兄弟姐妹。
在一项针对 54 人的试验中,研究人员发现,大约 90% 的接受来自半匹配供体移植的镰状细胞病患者在至少两年内没有出现排斥反应。范德比尔特大学血液学家阿德托拉·卡西姆领导了这项研究,他说,一些患者似乎完全治愈了。与基因疗法不同,这种“单倍体相合移植”仅需要短暂且毒性远低于基因疗法的化疗疗程。卡西姆说,这种方法可能是一种更经济实惠的选择:“我们使用的技术是可出口和可扩展的。”
当骨髓移植遥不可及时,针对下游生理问题的治疗方法可以解决,例如血红蛋白聚集,并缓解症状。“可以认为,世界上绝大多数镰状细胞病患者不太可能获得根治性治疗,”特伦说。“因此,我们有必要将其他药物推向市场,以改善他们的生活。”
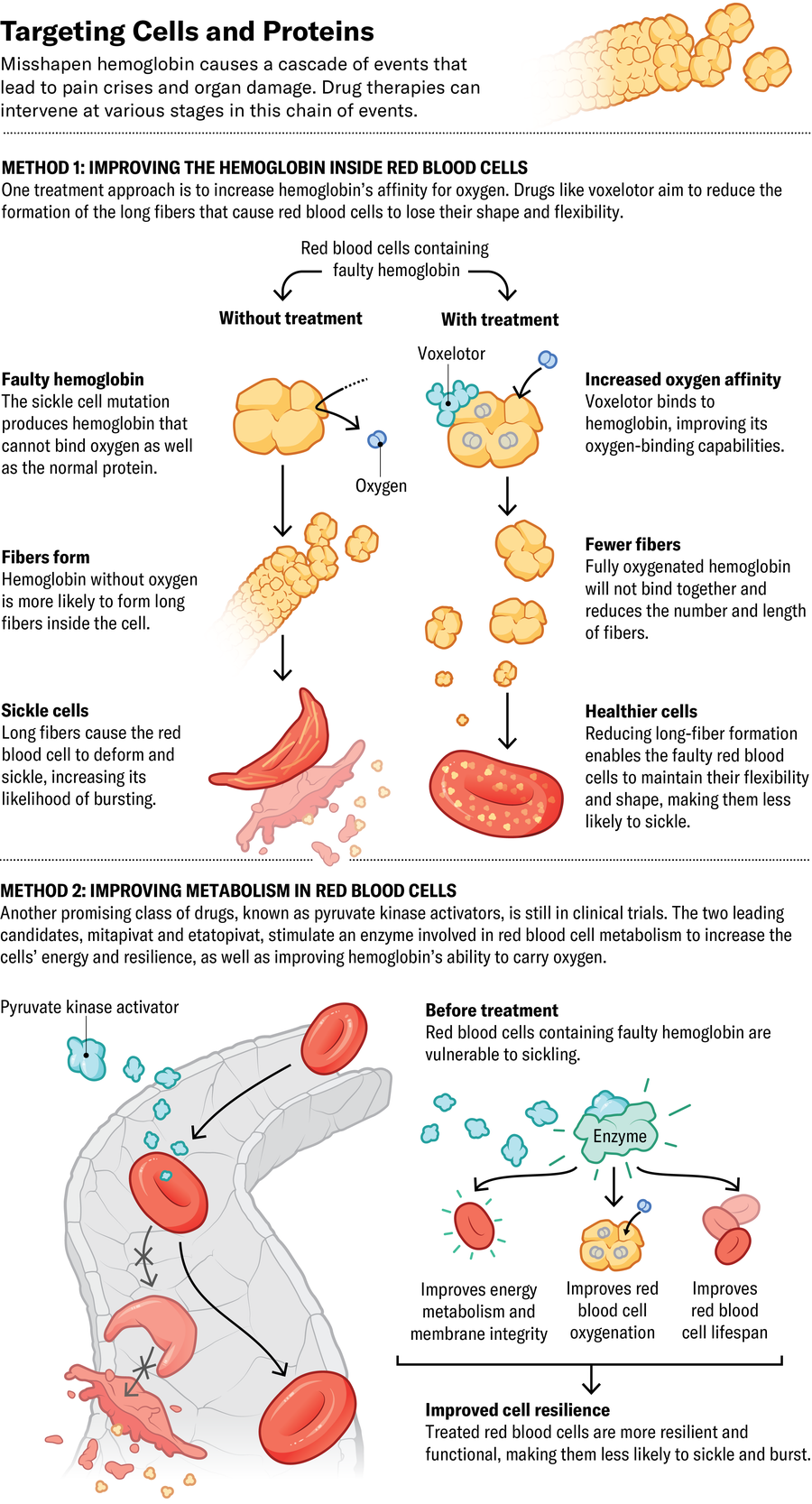
FDA 近年来批准了三种镰状细胞药物,还有数十种药物正在研发中。第一种新药于 2017 年获得批准,是 Emmaus Medicine 的 l-谷氨酰胺,一种有助于维持红细胞圆形形状的抗氧化剂。在一项临床试验中,食用混入食物或饮料中的 l-谷氨酰胺粉末的患者,其疼痛危象比安慰剂组的患者减少了 25%。
辉瑞公司的 voxelotor 和 osivelotor(后者正在临床试验中)都直接与血红蛋白结合,并提高其与氧气结合的能力。这种作用还可以防止蛋白质聚集并导致红细胞失去形状。FDA 和欧盟委员会分别于 2019 年和 2022 年批准了 voxelotor,此前数据显示它可以提高血红蛋白水平并防止严重贫血。“当它起作用时,它令人惊叹。它有点像奇迹药物,”纽约市西奈山伊坎医学院专门研究镰状细胞的急诊医生杰弗里·格拉斯伯格说。但有些患者没有反应,一项 3 期临床试验表明它并没有减少疼痛危象的次数。
Now Medical Studios;来源:美国血液学协会首席科学官凯莉·罗斯(顾问)
另一类有前景的药物,称为丙酮酸激酶激活剂,可刺激细胞代谢中涉及的一种酶,以增加细胞能量并提高血红蛋白携带氧气的能力。两个主要的候选药物,Agios Pharmaceuticals 的 mitapivat 和 Novo Nordisk 的 etavopivat,正在进行临床试验。
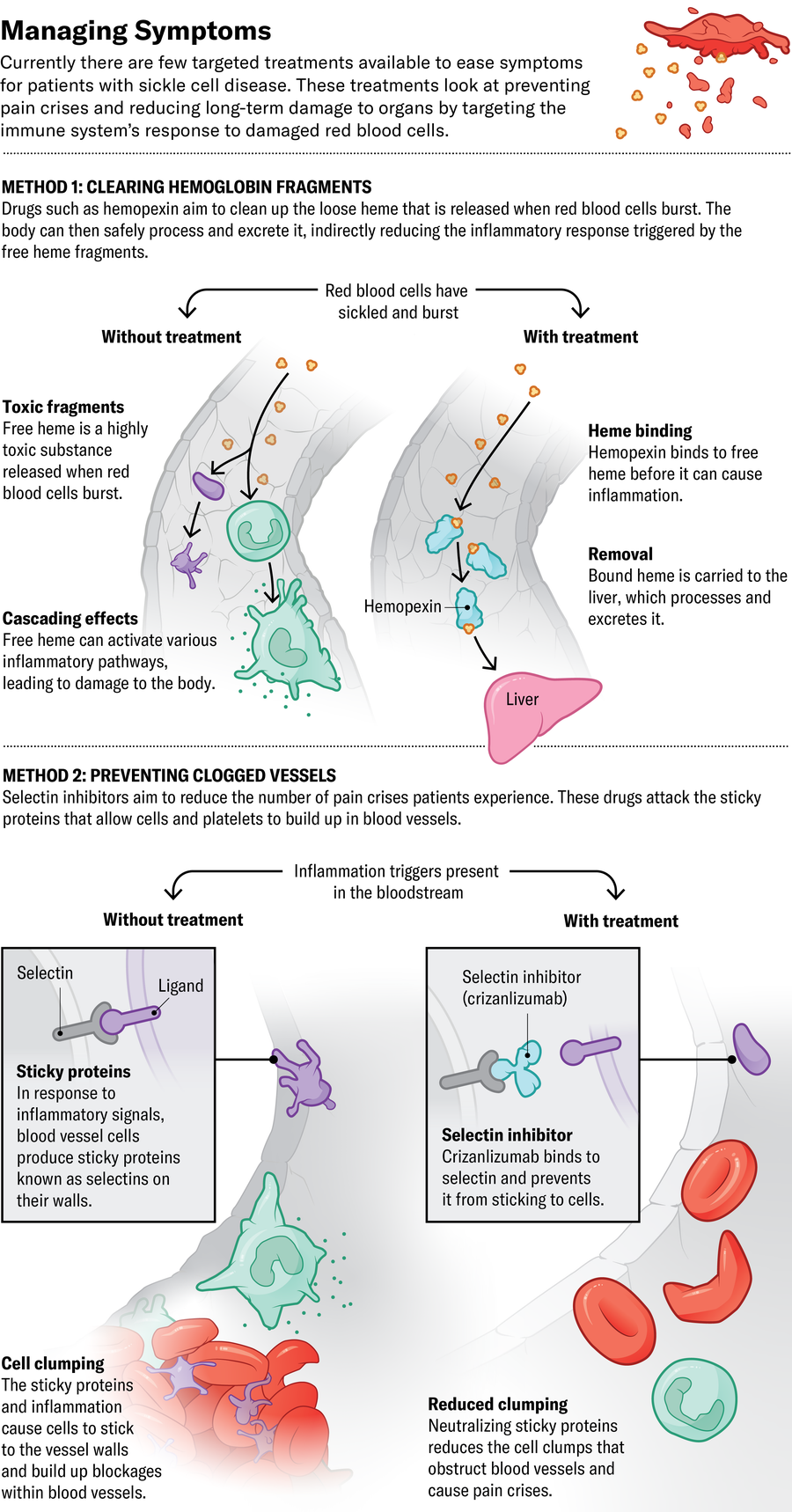
对于帮助正处于发病痛苦中的人,医生仍然几乎没有选择。通常,唯一可用的选择是止痛药和静脉输液。但针对红细胞以外物质的新药可能有助于应对急性危象,并减少长期导致疼痛和器官损伤的免疫反应。
FDA 最近批准的第三种药物,诺华公司的 crizanlizumab,攻击血管和血小板细胞上称为选择素的粘性蛋白质。阻断这些蛋白质可以防止红细胞在血管内聚集在一起,据推测可以预防疼痛危象。但它可能并没有那么简单。欧洲药品管理局在审查委员会发现它似乎没有减少人们经历的危象次数后,于 2023 年撤销了对 crizanlizumab 的批准。格拉斯伯格认为该药物仍然有用——他未发表的研究表明,crizanlizumab 和目前正在临床试验中的类似药物可以减少长期器官损伤和慢性肾脏病。
其他方法旨在减少免疫系统活动。CSL Behring 正在进行 hemopexin 的临床试验,这是一种清除已从红细胞中释放出来的血红蛋白的药物。游离血红蛋白会导致细胞在血管中聚集并导致炎症,从而导致长期器官损伤。其他地方的研究人员正在调查抑制某些称为补体蛋白的免疫信号分子的活性是否可以预防同样的基于炎症的损伤。
现在,格拉斯伯格和其他人正在努力确定哪些药物效果最好,以及某些组合是否可以协同作用。他目前正在西奈山进行一项名为 REAL Answers 的试验,其中 1,200 名患者将单独或组合接受 FDA 新批准的药物以及一种名为羟基脲的旧药。格拉斯伯格的团队正在评估它们对疼痛危象的影响,监测器官损伤的迹象,并寻找可以预测某人反应良好的遗传标记。
现在判断这些新疗法中的大多数将如何适应患者护理还为时过早。它们在生命早期开始时可能最有效。这些药物尚未在儿童的安全性和有效性方面进行广泛测试,但这种方法可能预防可能早期开始然后随着时间推移而恶化的器官损伤。
