基因编辑方法CRISPR已经改变了生物学,使科学家能够通过纠正危险突变来修饰基因以治疗或预防遗传疾病,并创造大量新的转基因植物和动物。但是,该技术涉及使用一种称为核酸酶的酶,它像分子剪刀一样“切割”DNA,可能会引起意想不到的副作用。在DNA中制造这种双链断裂会导致不必要的遗传物质被插入或删除,这可能会产生包括激活致癌基因在内的后果。如果不产生这些不良的遗传副产物,大多数突变都无法轻易纠正。
2016年,哈佛大学和麻省理工学院博德研究所的刘如谦(David Liu)领导的团队开发了另一种方法,称为碱基编辑,该方法允许科学家在不依赖双链断裂的情况下对单个DNA碱基进行精确编辑。然而,这项技术只能用于修复12种“点”基因突变中的4种,其中包括插入、缺失以及两者的组合。
现在,刘如谦、刘如谦实验室的博士后研究员安德鲁·安扎隆(Andrew Anzalone)及其同事开发了一种新的基因编辑工具,该工具避免了这些双链断裂,并且可以纠正所有12种类型的点突变。研究人员在实验室培养的人类细胞中使用了他们的新技术,称为“先导编辑”,以纠正导致镰状细胞病和泰-萨克斯病的基因缺陷,他们在周一发表在《自然》杂志上的一项研究中报告了这一发现。他们表示,他们的方法比传统的CRISPR更有效(在某些细胞类型中除外),并且脱靶效应更少。原则上,它可以纠正约89%的已知人类致病基因缺陷,尽管这仍然是一项非常新的技术,在用于治疗人类之前还需要进行更多的研究。
支持科学新闻报道
如果您喜欢这篇文章,请考虑订阅以支持我们屡获殊荣的新闻报道。 订阅。通过购买订阅,您正在帮助确保未来能够继续推出关于塑造我们当今世界的发现和想法的有影响力的报道。
“从宏观角度来看,先导编辑的发明是所有基因编辑工作者都应该欢呼雀跃的时刻,”加州大学伯克利分校分子与细胞生物学教授、加州大学伯克利分校和加州大学旧金山分校合作机构创新基因组学研究所的技术与转化科学主任费奥多尔·乌尔诺夫(Fyodor Urnov)说。“先导编辑可能是一种非常强大的[基因]修复方法,”乌尔诺夫说,他没有参与这项研究,但曾是该论文的审稿人。但他提醒说,“实际上,现在还处于非常早期的阶段。”
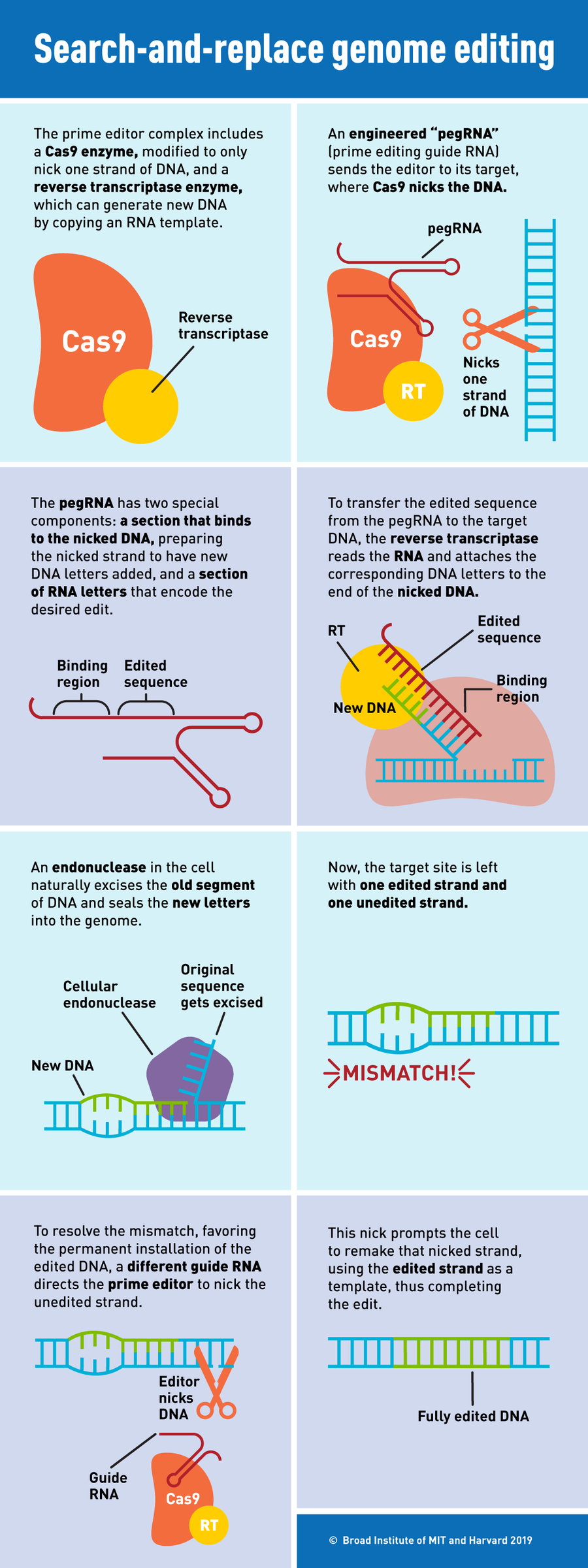
图片来源:S. Hamilton & K. Zusi,麻省理工学院和哈佛大学博德研究所
先导编辑器由两个组件组成:一种蛋白质和一个RNA分子。第一个是常见的CRISPR酶Cas9的工程改造形式,并与第二种酶——逆转录酶结合。第二个是工程改造的引导RNA,称为pegRNA,它既指定DNA中的靶位点,又充当所需编辑的模板。在靶位点,工程改造的Cas9在DNA的一条链上切开一个缺口,逆转录酶将pegRNA直接复制到附着在该点的新DNA链中,逐个碱基进行复制。这会创建一个带有编辑序列的额外DNA“瓣”。然后,先导编辑器切割未编辑的链,并将其替换为编辑后的链。
“如果说核酸酶[如Cas9]像剪刀,碱基编辑器像铅笔,那么先导编辑器就像文字处理器,”刘如谦说。它们为DNA提供了一种“搜索和替换”功能。
安扎隆和他的同事将先导编辑与CRISPR的常用DNA修复机制进行了比较,发现新方法更有效(意味着它成功编辑了更高比例的细胞),并且产生的插入和缺失要少得多。通过先导编辑,该团队能够实现约20%至50%的效率——在某些情况下,根据细胞类型的不同,效率高达78%。对于某些疾病,如镰状细胞病,即使25%至30%的效率也可以缓解某些症状。其他疾病,如囊性纤维化,则需要更高的效率。
已知CRISPR酶Cas9在基因组中的多个位点具有意想不到的或脱靶效应。研究人员表明,先导编辑在这些位置引起的脱靶效应更少。他们认为发生这种情况的原因是,Cas9只需要一次DNA配对,而先导编辑需要三次,这意味着可能产生不良影响的随机配对的可能性较低。
其他研究人员称赞了这种新方法,尽管他们指出该技术仍处于早期阶段。多位CRISPR先驱之一的张锋(Feng Zhang)也在博德研究所工作,但没有参与这项研究,他称其为“一种创造性的方法,进一步扩展了可以进行的基因改变范围。”(张锋是Editas Medicine和Beam Therapeutics公司的联合创始人,这两家公司正在开发基于CRISPR的疗法。)
剑桥大学生物化学教授尤西·泰帕勒(Jussi Taipale)称其为“重大进展”,它“从基因组切割工具转向真正的基因组编辑工具。”
“很高兴看到CRISPR-Cas9工具箱中又多了一个工具!”加州大学伯克利分校的CRISPR先驱詹妮弗·杜德纳(Jennifer Doudna)补充道,她不是这项研究的共同作者,但与刘如谦的实验室有合作。(杜德纳是Caribou Biosciences、Editas Medicine、Scribe Therapeutics和Mammoth Biosciences的联合创始人——所有这些公司都在从事CRISPR技术的研究。)
像所有新技术一样,先导编辑也有其局限性,在科学家考虑将其用于人体之前,必须克服这些局限性。首先,研究人员必须弄清楚如何以安全有效的方式将该工具递送到体内的细胞,使其到达目标细胞。安扎隆和他的同事在他们的研究中探索了病毒和非病毒递送方法,他们计划在动物身上进行更多的研究。
乌尔诺夫说,另一个问题是,工程改造的酶和RNA是否会激活人体的免疫系统。RNA最初来自细菌,酶来自病毒,因此两者是“我们从未见过的嵌合体”,他补充道。(传统的CRISPR也面临类似的挑战。)
张锋说,引入逆转录酶也可能将细胞中的其他RNA复制到DNA中,然后整合到基因组中,从而引起不良影响。
最后,还有效率问题。张锋说,他们取得的成果很有希望,但需要在某些疾病特定的细胞类型中加以改进。
先导编辑不太可能取代CRISPR或碱基编辑等技术。“核酸酶编辑器[如Cas9]、碱基编辑器和先导编辑器都有优点和缺点,”刘如谦指出。“我们预计这三类工具都将在治疗和研究中发挥作用,”他说。
乌尔诺夫将不同的基因编辑工具比作犬种——每种犬种都有其专门的功能。例如,边境牧羊犬擅长放羊,而德国牧羊犬则适合做警犬。当谈到基因编辑时,他说,“我真的认为我们没有足够的数据来判断哪种‘犬’将被最广泛地使用。”
