在一个月光皎洁的夜晚,三个虚构的狂欢者在英国荒原上被可怕的景象惊呆了:“一个污秽的东西,一个巨大的黑色野兽,形状像猎犬,但比凡人眼睛见过的任何猎犬都大。就在他们看着的时候,那东西撕开了雨果·巴斯克维尔的喉咙,当它转过头,滴着血的下巴对着他们时,三个人尖叫着恐惧,策马狂奔逃命。”医学史学家追溯了《巴斯克维尔的猎犬》在阿瑟·柯南·道尔的粉丝中引起的恐惧,这源于狂犬病对当时英国社会意识的深刻影响。狂犬病毒能够将最温顺的宠物变成口吐白沫、狂怒咆哮的野兽,并且死亡率几乎达到 100%,是人类历史上最令人恐惧的灾难之一。
早在 1804 年,德国医生格奥尔格·戈特弗里德·津克 (Georg Gottfried Zinke) 的实验就表明,病毒在受感染动物的唾液中浓度很高。这种病菌还能增强唾液的产生,同时增加口腔中唾液的含量——这解释了为什么患狂犬病的狗会流口水。路易斯·巴斯德在 19 世纪 80 年代进一步证明,大脑也感染了这种病毒。这一切都不是偶然的。两个世纪的研究现已证实,狂犬病毒结合了一种倾向,即从受感染动物沾满唾液的下巴转移,并具有一种恶魔般的能力,驱使其陷入狂怒的攻击性咬伤。通过进化上的壮举,病毒操纵宿主的大脑,以确保自身有效传播。
狂犬病每年仍导致超过 59,000 人死亡。然而,由于疫苗接种和对受感染动物的隔离,它在发达国家不再引起恐慌。相反,神经科学家正在将这种恶性病菌转变为人类的优势。狂犬病毒擅长从咬伤部位到达大脑,通过偷偷地从神经元跳跃到神经元——从而逃避免疫系统的检测。包括我在伦敦圣斯伯里维康神经回路与行为中心小组在内的许多研究人员,现在已经利用和改进了这种能力,以可视化神经元之间的连接。
支持科学新闻报道
如果您喜欢这篇文章,请考虑支持我们屡获殊荣的新闻报道,方式是 订阅。通过购买订阅,您正在帮助确保未来能够继续讲述关于塑造我们当今世界的发现和思想的具有影响力的故事。
人脑由数十亿个神经元组成,每个神经元与数千个其他神经元相连;绘制这个错综复杂的网络对于理解大脑如何产生我们的情感和行为至关重要。利用基因工程改造的狂犬病毒,我们现在可以观察特定类型的神经元接收何种输入,电信号如何从眼睛传递到大脑,以及哪些类型的神经元控制姿势以防止我们摔倒。尽管该领域仍处于起步阶段,但在未来,这些信息可能有助于我们理解神经退行性疾病(如帕金森病),并可能找到治疗方法。
从咬伤到大脑
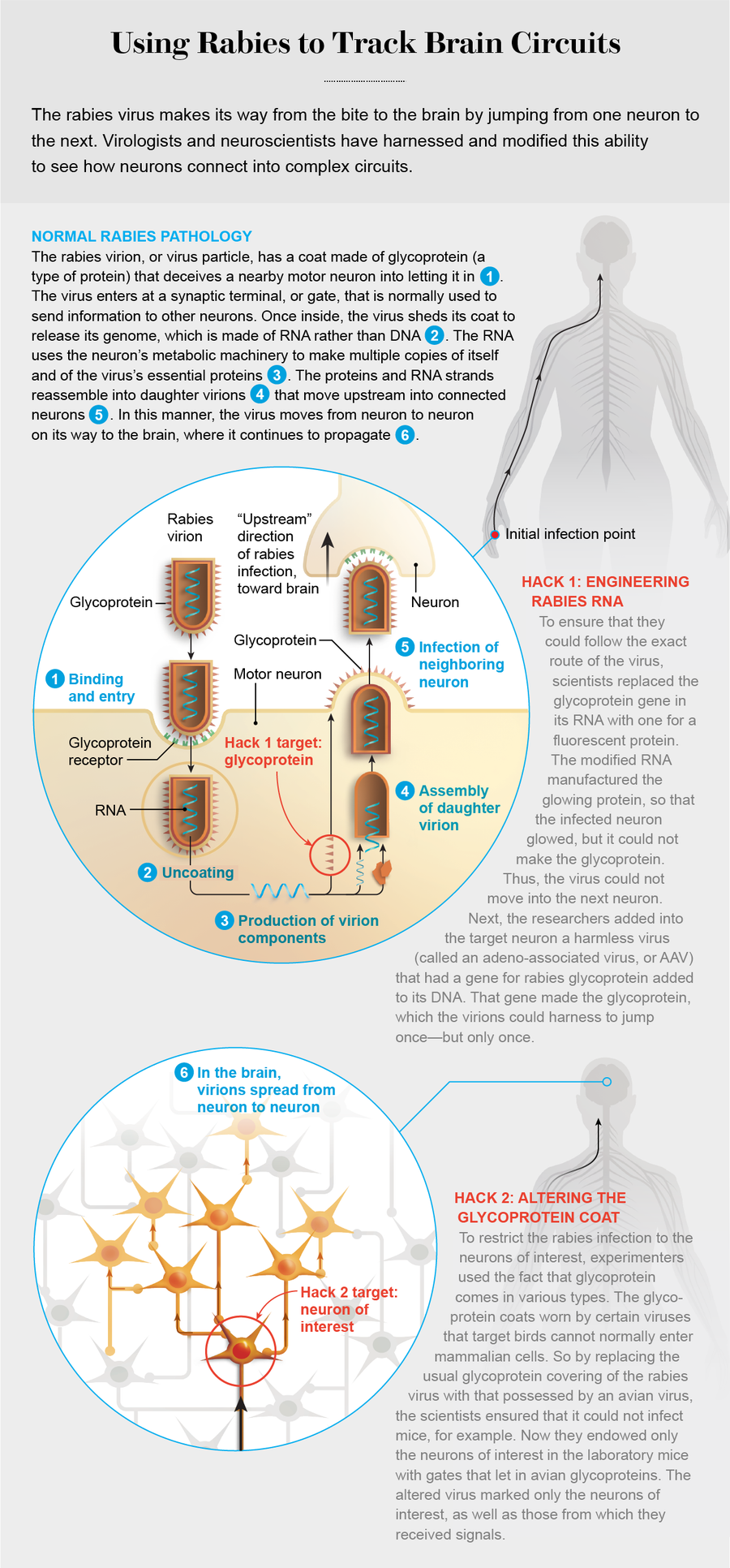
首先,咬伤会将病毒粒子或病毒颗粒注入肌肉组织。狂犬病毒粒子呈子弹状胶囊,包含单链 RNA 和蛋白质,表面覆盖着一种称为糖蛋白的尖刺蛋白。这种外壳欺骗了将突起发送到攻击部位的运动神经元,使其将病毒带入细胞内部。运动神经元释放化学物质,导致肌肉收缩,它们通过一长串其他神经元与受害者的脑部相连——病毒的最终目的地。
确切地说,糖蛋白与神经元突触末梢上的受体结合:突触末梢是神经元向相邻神经元传递信号的点。就像机场安全区域唯一的出口门一样——而不是入口——突触末梢保护着神经元之间单向通道——突触。按照惯例,突触的“下游”方向是信号从一个神经元到下一个神经元的流动方向,一直从大脑到肌肉。然而,狂犬病毒逆流而上,因为它必须到达大脑。因此,它欺骗受体,通过出口门进入运动神经元。
病毒擅长利用宿主细胞为自己服务,但很少有病毒能在这方面胜过狂犬病毒。一旦进入细胞内部,入侵者就会脱掉糖蛋白伪装,其 RNA 开始工作,利用细胞的物质和代谢来产生自身的副本以及所有特征蛋白。然后,这些成分重新组装以产生子代病毒粒子。许多病毒种类复制速度非常快,以至于它们迫使受感染的细胞破裂,将病毒粒子释放到细胞之间的空间中,而狂犬病毒则严格调节其繁殖——仅产生足够的子代以继续前进。这样,它就避免了造成如此大的损害以至于惊动免疫系统。相反,它使宿主细胞完整无损,并穿过突触到达新的上游神经元。这种偷偷摸摸是该疾病潜伏期如此之长(通常在人类中为一到三个月)的原因之一。
就这样跳到新的神经元后,病毒粒子再次开始整个过程:脱掉伪装并复制自身,然后重新组装子代,这些子代移动到下一个上游神经元。通过这种方式,狂犬病毒在神经系统中选择了一条路径,从它最初在肌肉组织中遇到的运动神经元,通过脊髓,进入大脑。
到 21 世纪初,包括现就职于巴黎-萨克雷神经科学研究所的加布里埃拉·乌戈里尼 (Gabriella Ugolini) 和现就职于匹兹堡大学的彼得·斯特里克 (Peter Strick) 的几个研究小组,都在致力于利用狂犬病作为神经元回路的示踪剂。然而,破译病毒从肌肉到大脑的路径是一个挑战。作为一名神经科学家,在观察已被病毒感染的神经元快照时,您如何区分入侵者从一个神经元到下一个神经元的第一次跳跃、第二次跳跃等等?
研究人员最初通过在感染后不久对实验动物实施安乐死来解决这个问题,从而使病毒仅在一到两个突触之间传播。这种方法揭示了大脑中一些有助于运动控制的主要通路。但这有其缺点。并非神经元之间的所有连接都是平等的。一个突触可能是强(或弱)的,这使得信号跨越它移动时更有可能(或更不可能)促使目标神经元做出反应。另一个突触可能位于靠近细胞体的位置,而不是远离突起的末端。一些神经元与下游神经元建立单个连接,而另一些神经元则可能建立数百个连接。这种异质性意味着病毒从一个神经元传播到下一个神经元所需的时间长短不一,从而增加了一层不确定性。如果病毒在穿过一个弱突触之前先穿过两到三个强突触怎么办?
病毒工程
为了解决这个问题,科学家需要改造狂犬病毒。分子生物学家已经发展出操纵 DNA 的惊人能力:基因交换对他们来说已变得像在实验室厨房里煮咖啡一样 routine。然而,野生狂犬病毒没有 DNA 可供操纵,只有 RNA。逆转遗传学的出现绕过了这个障碍,逆转遗传学通过从 DNA 制造 RNA 来颠倒正常的遗传周期。1994 年,当时都在德国蒂宾根动物病毒疾病联邦研究中心的马蒂亚斯·施内尔 (Matthias Schnell) 和卡尔-克劳斯·孔泽尔曼 (Karl-Klaus Conzelmann) 仅从克隆 DNA 在实验室中产生了功能性狂犬病毒。他们甚至改变了狂犬病毒基因组:编码其特征特性的 RNA 链。
操纵基因组的能力迅速加深了人们对不同狂犬病毒基因如何影响病毒的各种技能的理解。事实证明,只有一个基因对于病毒在神经元之间移动的能力至关重要:编码糖蛋白的基因。从其基因组中删除糖蛋白基因的狂犬病毒可以感染细胞,但一旦进入细胞内部,它就会被困在那里。这将是将病毒推向主流神经科学的发现。
2007 年,当时都在加利福尼亚州拉霍亚市索尔克生物研究所的神经科学家伊恩·威克沙姆 (Ian Wickersham) 和爱德华·卡拉韦 (Edward Callaway) 与德国弗里德里希-勒夫勒研究所的病毒学家孔泽尔曼和斯特凡·芬克 (Stefan Finke) 之间的合作产生了一个巧妙的系统来绘制神经元回路图。他们计划的第一步是用编码荧光蛋白的基因替换狂犬病毒基因组中的糖蛋白基因。经过基因工程改造的病毒粒子无法制造糖蛋白;相反,其 RNA 制造荧光蛋白(以及所有其他狂犬病毒蛋白)的副本——因此受感染的细胞会发出实验者选择的明亮颜色。
第二步是通过一些其他遗传机制在目标神经元中提供糖蛋白。这样,子代病毒粒子就可以穿上糖蛋白外壳并跳跃一次——但仅此一次。为此,科学家们利用了一种非常简单的病毒类型,称为腺相关病毒 (AAV),因为它通常与称为腺病毒的更大病毒一起发现。AAV 含有少量的 DNA。索尔克研究所的研究人员将一个用于制造狂犬病毒糖蛋白的基因插入到该 DNA 中。狂犬病毒粒子可以利用该基因制造的糖蛋白跳过单个突触。但是,它无法将糖蛋白基因带走,因为它是一段 DNA,而不是 RNA。因此,当病毒粒子跳入下一个细胞时,它再次被困住。那时,看一眼受感染动物的大脑,就会发现遍布神经系统的发光细胞群,这些细胞群与研究人员想要靶向的任何神经元直接相连。
然而,仍然存在一个问题。将狂犬病毒注射到大脑中会导致任何将突起发送到注射部位的神经元直接感染。如果无法将狂犬病毒的初始感染限制在特定神经元,科学家就无法区分直接被注射病毒感染的神经元和病毒穿过突触后感染的神经元。解决方案将来自病毒学的另一个领域:专门感染鸟类的病毒。
在野外,可以找到整类病毒,它们只感染某些动物群体。例如,禽肉瘤白血病病毒 (ASLV) 通常会导致鸡患癌症,但通常不能感染哺乳动物细胞。与狂犬病一样,这种病毒也有一种糖蛋白包膜,它有多种构型。不同的 ASLV 糖蛋白被称为 Env(代表包膜),后跟特定形式的标签。每个亚型都与特定的受体结合。例如,EnvA 与称为 TVA(代表禽肿瘤受体病毒 A)的受体结合。如果细胞不具有 TVA 受体,则它不能被 EnvA 包膜的病毒感染。这种选择性相互作用使研究人员能够将狂犬病毒的初始感染限制为一种类型的神经元。
通过在感染狂犬病毒的细胞培养物中引入 EnvA 糖蛋白基因(一种称为假型化的过程),威克沙姆、卡拉韦及其同事用禽病毒的 EnvA 糖蛋白取代了狂犬病毒上的天然糖蛋白外壳。经过如此改变,狂犬病毒无法欺骗任何哺乳动物细胞让其进入。通过赋予感兴趣的神经元(通常在小鼠大脑中)TVA 受体,神经科学家可以确信狂犬病毒只会感染该细胞。
目标神经元(实际上是一类神经元)也配备了含有狂犬病毒糖蛋白基因的 AAV。一旦进入细胞内部,狂犬病毒就会脱下它的鸡服装,穿上它的正常外套,并跳入上游神经元。通过对狂犬病毒进行基因工程改造,使其仅从一组明确的“起始”神经元感染并跳跃一次,研究人员现在可以清楚地了解大脑是如何连接的。
调整狂犬病毒
delta-G 狂犬病系统(因其发明者称之为改变的糖蛋白而得名)的简单性和优雅性席卷了神经科学界。使用该系统,研究人员可以立即看到哪些类型的神经元向感兴趣的神经元发送信号。然而,像所有新技术一样,该方案也有其不完善之处。有时标记的连接数量相当少——每个起始神经元大约 10 个。
图片来源:凯莉·墨菲
大约在 2015 年,当时都在哥伦比亚大学的托马斯·里尔登 (Thomas Reardon)、托马斯·杰塞尔 (Thomas Jessell)、阿提拉·洛松齐 (Attila Losonczy) 和我,正在使用 delta-G 系统来理解引导运动指令的神经回路。在脊髓或大脑中的运动神经元中发现的连接数量相对较少,我们怀疑我们得到的电路图是不完整的。另一个问题是神经毒性。一旦病毒进入细胞,它就会在几周内开始分解并死亡。如果病毒本身正在导致单个神经元改变其行为,那么解释任何观察结果都可能存在问题。
施内尔和克里斯托夫·维尔比希 (Christoph Wirblich) 都就职于托马斯·杰斐逊大学,他们在狂犬病毒生物学方面做了开创性的工作,因此我们向他们寻求帮助。他们立刻知道我们的问题源于我们正在使用的病毒株。它最初是为狂犬病疫苗而开发的。疫苗包含人类选择的特殊病菌株,这些病菌株繁殖异常迅速,因此大量的子代病毒粒子从受感染的细胞中爆裂出来,并在为时过晚之前提醒免疫系统。这指明了改进我们研究工具的方向。由于我们在研究中使用小鼠,我们的病毒学家合作者建议我们尝试一种经过多年调整以感染小鼠神经元的毒株。
该毒株的亲本病毒最初是在野外分离出来的,然后通过反复在小鼠大脑或细胞系中传代“固定”在实验室中。因此,它已经进化成为专门针对小鼠神经系统的专家。在组装了基于这种小鼠特异性毒株的神经元示踪机制后,我们发现它标记的连接比我们之前看到的要多得多。此外,由于它是逃避小鼠免疫系统的专家,因此它产生的每种蛋白质的量相对较少。因此,它对宿主细胞机制的压力较小,并允许神经元保持相对健康的状态。
我们进一步改变了我们的示踪系统,用编码光敏蛋白(称为通道视紫红质 (ChR),最初在绿藻中发现)的基因替换了狂犬病毒中荧光蛋白的基因。当被蓝光激活时,这种非凡的分子打开了一个通道,允许带正电的离子流入目标神经元,从而促使其发出电信号。(然而,受感染的细胞继续发光,因为我们使用了包含荧光蛋白的 ChR 版本。)借助这种微调的狂犬病毒系统,我们可以观察整个神经元回路在小鼠的某些动作期间放电,或者打开或关闭它们——最长可达病毒感染神经元后的一个月。这为我们提供了充足的时间来进行许多我们需要进行的测试,以了解特定回路如何产生行为。
布线图
利用不同版本的 delta-G 狂犬病系统,神经科学家已经探测了神经系统中的许多不同回路,以了解它们如何影响动物的感知和行为。以视觉系统为例。当光线进入眼睛时,视网膜后部的神经元(称为视网膜神经节细胞)会将信号传递到大脑。神经科学家传统上认为,这些信息传递到大脑中的中间位置,最终到达大脑皮层——著名的灰质——在那里进行处理。瑞士弗里德里希·米歇尔生物医学研究所的博顿德·罗斯卡 (Botond Roska) 小组使用狂犬病系统追踪了从视网膜神经节细胞到外侧膝状体核 (LGN) 的输入,外侧膝状体核是大脑中被认为是皮层中继站的区域。
研究人员证明,LGN 包含三种不同类型的神经元,每种神经元可能以不同的方式处理视觉信息。事实上,只有不到三分之一的神经元充当了中继站,提供了从视网膜到皮层的直接线路。但大约另有三分之一的神经元接收来自一只眼睛的不同输入的组合;其余神经元(约 40%)接收来自双眼的信号。因此,尽管 LGN 位于视觉回路的早期阶段,但其大部分神经元都整合了来自多个来源的信息。这一发现可能会阐明大脑解释来自眼睛的信息的过程。
在哥伦比亚大学,我的同事和我研究了外侧前庭核 (LVN) 中的神经元,这是一个试图防止我们摔倒的大脑区域。想象一下,你在一辆行驶中的地铁列车上,列车突然意外停下。在您有时间思考之前,您会移动双脚进行补偿,绷紧双腿,甚至抓住最近的杆子。大脑如何在各种类似情况下如此迅速地激活正确的肌肉群?
我们发现,小鼠的 LVN 包含两种解剖学上不同的神经元类型,每种神经元类型都具有与神经系统不同部位的不同下游连接。一组神经元在您的大脑感知到您的身体不稳定后会非常迅速地启动;这些神经元的作用是伸展四肢以扩大支撑面。稍后,第二组 LVN 神经元变得活跃。这些神经元的作用是加强和稳定同一肢体的关节,使身体能够被推回原来的位置。我们可以通过简单地打开蓝光来激活这些神经元,蓝光通过光纤电缆传输到 LVN。当光线亮起时,小鼠会调整其四肢的位置,就好像是为了阻止自己摔倒一样——即使它们没有失去平衡。
哈佛大学的内奥·内奇达 (Nao Uchida) 实验室调查了第三个重要问题:释放多巴胺的神经元的功能是什么?长期以来,人们知道大脑中两个区域(黑质致密部 (SNc) 和腹侧被盖区 (VTA))中的此类“多巴胺能”神经元会对奖励做出反应。当实验动物获得奖励或感官刺激预示着奖励即将到来时,它们会变得非常兴奋。(想想吃一块糖果,与听到糖果包装纸的沙沙声相比。)为了了解神经元接收何种类型的信息,科学家需要知道它们是如何连接到其他脑回路的。哈佛大学团队使用 delta-G 系统发现,SNc 中的多巴胺能神经元接收有关刺激相关性的信息:这种糖果包装纸的声音会让我得到一块巧克力吗?相比之下,VTA 接收有关奖励质量的信息:这块糖果有多好吃?
碰巧的是,SNc 中的多巴胺能神经元会在帕金森病中退化。有趣的是,内奇达及其同事还发现,SNc 中此类神经元的主要输入来自丘脑底核,丘脑底核是大脑中一个小的、透镜状区域,与类似的核一起参与控制运动。通过插入电极来刺激丘脑底核(一种称为脑深部刺激的技术)通常可以有效缓解帕金森病的症状。神经科学家推测他们发现的输入解释了为什么这种刺激有效,他们推断,靶向他们已确定也向 SNc 发送输入的其他大脑区域,可能会帮助一些帕金森病患者。
因此,自然进化和有针对性的工程相结合,为神经科学家提供了一种非常强大的工具。仍有很大的改进空间。例如,是否有可能对病毒进行基因工程改造,使其向下游移动,标记神经元的输出而不是输入?我们能否制造出一种仅标记神经元之间活跃连接的病毒,从而点亮参与不同行为的回路?是时候让这种操纵和恐吓人类数千年的病毒被操纵来为我们服务了。