当玛丽·戴维斯因治疗乳腺癌的药物差点丧命时,她向身为科学家的丈夫提出了挑战:他是否愿意将研究重点转向设计更好的癌症疗法?作为加州理工学院帕萨迪纳分校的化学工程师,马克·戴维斯当时正在制造用于化学合成的固体催化剂。但在 1996 年,在玛丽经历了高毒性化疗药物多柔比星(被称为“红色死亡”)的痛苦之后,他听从了妻子的恳求,开始着手这项工作。
戴维斯运用他的工程技术,设计出一种比人类头发丝宽度还要小千分之一的盔甲状颗粒,用于包裹药物喜树碱。大约在妻子接受治疗十年后,他亲眼目睹医生将这种分子(现在称为 CRLX101)注射到第一位患者雷·纳塔体内。“这是我做过的最可怕的事情,”戴维斯回忆道。在为期六个月的安全性试验中,纳塔的胰腺癌(已扩散到肺部)得到了遏制。而且,与未受保护的药物相比,这种纳米颗粒包覆的药物似乎引起的副作用更少。
在有毒分子周围构建保护层可以解决癌症治疗中最大的遗留挑战之一——如何在攻击癌细胞时保护健康细胞。化疗药物通过杀死快速分裂的细胞来阻止导致肿瘤的癌细胞过度生长。但是,这些药物通过供应全身的血管网络到达癌细胞。而且,正如玛丽·戴维斯的经历所表明的那样,它们同样有可能毒害健康细胞和癌细胞。
支持科学新闻报道
如果您喜欢这篇文章,请考虑通过以下方式支持我们屡获殊荣的新闻报道 订阅。 通过购买订阅,您将帮助确保有关塑造我们当今世界的发现和思想的具有影响力的故事能够继续存在。
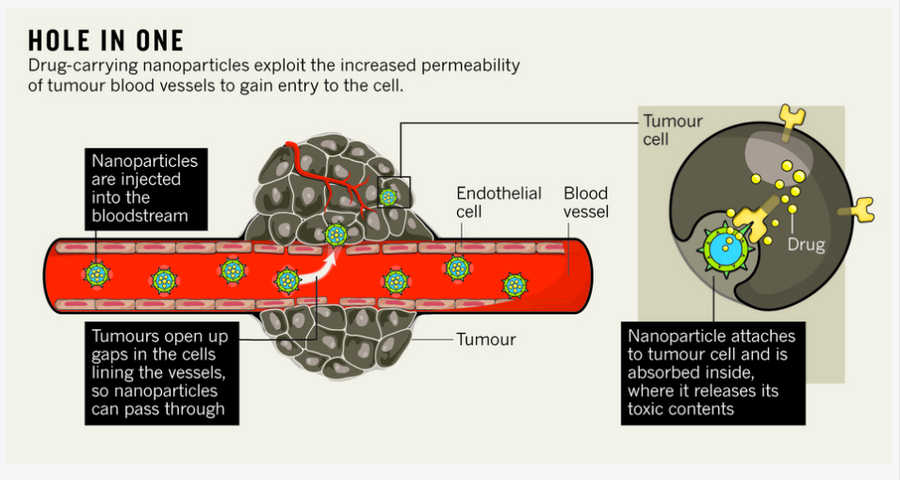
因此,研究人员正在研究将药物直接输送到癌组织的方法。药物输送是一个多阶段的旅程:活性成分需要进入人体,通过血液循环到达肿瘤部位,穿透肿瘤块,然后进入细胞(见下文“一杆进洞”)。通过改进每个步骤,研究人员的目标不仅仅是保护身体免受有毒药物的侵害。开创性的药物输送系统旨在运输有效载荷——从剧毒分子到遗传物质——这些物质绝不应单独在体内循环,并比现在可能实现的更精确地靶向癌细胞。
武装抗体
纽约市阿尔伯特·爱因斯坦医学院的癌症外科医生史蒂文·利布蒂说,癌症治疗进展的许多兴奋点都集中在靶向癌症特异性生物途径的药物上。“但这种方法可能无法实现我们所希望的承诺,因为肿瘤本身会躲避这种策略,”他说。另一种方法是使用对所有细胞都有毒性的强效药物,但将这些药物限制在良性的“特洛伊木马”中,直到它们到达肿瘤,他说。
最简单的方法之一是用细胞杀伤药物武装寻癌蛋白。在 20 世纪 90 年代后期,制药公司开发出与某些类型癌细胞表面结合的抗体。将这些蛋白质与药物通过稳定的化学连接剂融合,产生强大的组合:抗体促进药物被癌细胞摄取,而连接剂则阻止药物在进入细胞内部之前发挥作用。“这是一个简单的想法,”位于马萨诸塞州沃尔瑟姆的 ImmunoGen 公司的首席科学官约翰·兰伯特说,该公司开发并授权了将抗体与药物连接的技术。“但这花了很长时间才将所有部件组装在一起。”
市场上只有两种抗体-药物偶联物 (ADC) 疗法。第一种名为 brentuximab vedotin(由华盛顿州西雅图基因公司以 Adcetris 的名称销售),于 2011 年获得美国食品和药物管理局 (FDA) 批准,用于治疗某些类型的淋巴瘤(淋巴系统癌症),这些淋巴瘤对以前的治疗没有反应。第二种 trastuzumab emtansine(由加利福尼亚州南旧金山的基因泰克公司以 Kadcycla 的名称销售),于 2013 年被批准作为晚期乳腺癌的治疗方法,用于在接受传统化疗药物治疗后。
Trastuzumab emtansine 将有毒化疗药物 emtansine 与抗体融合,这些抗体与一种名为 HER2 的蛋白质受体结合,HER2 在大约 20% 的乳腺癌中过度产生。在一项于 2012 年完成的 III 期试验中,服用该药物的近 500 名女性比接受标准治疗的女性寿命延长了约五个月,副作用也更少
1。兰伯特说,研究中的所有女性都处于疾病晚期,但由于试验的积极结果,该药物现在正在进行临床试验,作为一线治疗药物。几种类似的药物目前正处于高级临床试验阶段,ImmunoGen 正在尝试将 emtansine 与靶向其他癌症(从淋巴瘤到肺癌和卵巢癌)的抗体连接。包覆纳米颗粒
与传统的单克隆抗体一样,ADC 需要自行前往肿瘤部位。“你注射的分子不知道癌细胞在哪里,”兰伯特说。“如果它们经过癌细胞,它们可以附着,但大多数会去其他地方。”
一种方法是在化疗药物周围添加一层包衣。由此产生的纳米颗粒直径约为 20 到 100 纳米,对于大多数血管来说都太大而无法逃脱。但它们确实找到了从快速生长的肿瘤匆忙构建的渗漏血管中逃逸的途径。因此,人们认为它们会优先在肿瘤部位积聚。然而,北卡罗来纳大学教堂山分校的药理学家鲁道夫·朱利亚诺说,这种现象主要在动物模型中研究过,而不是在人体中研究过。
纳米颗粒可以携带比抗体更强的有效载荷,将数千种药物包裹在一个分子中。然而,不幸的是,它们也会在肝脏和脾脏中积聚,在那里它们不会产生治疗益处,反而会引起副作用。为了最大限度地减少不良影响,研究人员用一层聚乙二醇包覆颗粒,聚乙二醇模仿水,有效地将药物隐藏起来,使其免受检测和吞噬入侵者的肝细胞的侵害。但朱利亚诺说,最大限度地减少肝脏摄取仍然是纳米颗粒设计的重要组成部分。
最早开发的用于药物输送的纳米颗粒用脂质包覆活性成分。第一个获得批准的此类药物是 1995 年的 Doxil。Doxil 携带多柔比星,用于治疗卡波西肉瘤和其他实体瘤,包括乳腺癌和卵巢癌。
根据美国国家癌症研究所的数据,目前全球市场上有六种此类纳米颗粒获得批准用于使用。到目前为止,它们似乎提高了安全性——Doxil 不会最终进入心脏,而多柔比星会在心脏中引起毒性——但没有提高疗效。因此,一些研究人员质疑纳米技术是否值得伴随其生产的高昂价格标签:它的成本可能是传统治疗的十倍。“新的基于纳米颗粒的药物输送将是昂贵的,并且必须通过改善的治疗效果来证明其合理性,”朱利亚诺说。“我们仍处于太早的阶段,无法确定这一点。”
尽管如此,纳米颗粒药物输送可以产生显着且有价值的效果,加利福尼亚州杜阿尔特市希望之城癌症中心的肿瘤学家云严说,他曾向纳塔施用 CRLX101(由马萨诸塞州剑桥市的 Cerulean Pharma 公司开发)。“当你看到一位病人,你期望他们的血细胞计数下降,你期望他们会恶心,但他们做得很好,这真是太神奇了,”他说。
为输送而工程设计
马萨诸塞州波士顿哈佛医学院的医生科学家、马萨诸塞州三家基于纳米技术的生物技术公司的创始人奥米德·法罗克扎德说,纳米技术尚未充分发挥其潜力,因为到目前为止,它仅用于运送旨在通过传统方法给药的药物。法罗克扎德的公司之一,沃特敦的 Blend Therapeutics,正在致力于专门为纳米颗粒使用而设计的药物。
法罗克扎德的另外两家公司——剑桥的 BIND Therapeutics 和沃特敦的 Selecta Biosciences——使用一种技术,该技术工程化一条长的聚合物链,该链可自发折叠形成颗粒。聚合物中散布着靶向配体,旨在将颗粒连接到癌细胞。自组装使科学家更容易在不同的批次中复制分子——这是将该技术转化为临床的关键优势。在 2012 年的一项研究中,法罗克扎德和他的同事筛选了 100 种聚合物,这些聚合物结合了一种与前列腺特异性膜抗原 (PSMA) 结合的分子,PSMA 显示在大多数前列腺肿瘤的表面
2。这些颗粒包裹着化疗药物多西他赛。最有希望的纳米颗粒 BIND-014 正在进行治疗肺癌和前列腺癌的 II 期试验。
一些研究人员正在从传统的化疗中分支出来,并使用纳米颗粒将 RNA 小片段输送到癌细胞,在那里它们降低某些基因的表达,这种方法称为 RNA 干扰。戴维斯说,使用纳米颗粒输送 RNA 是很有希望的,因为它允许研究人员一次性到达多个基因,从而到达多个通路。他开发了第一个进入癌症临床试验的 RNA 携带纳米颗粒。该颗粒名为 CALAA-01,靶向基因 RRM2,该基因参与细胞分裂,并使用与转铁蛋白受体结合的分子(转铁蛋白受体在癌细胞上高度表达)进入细胞内部
3。CALAA-01 进入了治疗黑色素瘤的 I 期临床试验,但后续试验因原因不明而被暂停。
其他努力旨在将药物直接输送到肿瘤。加拿大蒙特利尔理工学院的生物医学工程师西尔万·马特尔正在构建磁性颗粒,研究人员将能够引导这些颗粒到达肿瘤。这些颗粒使用与磁共振成像 (MRI) 中相同的造影剂,因此当患者在 MRI 扫描仪中时,研究人员可以在肿瘤顶部使用强磁场来引导药物到达正确的部位。马特尔和他的同事已经在猪身上测试了该方法,并计划在人身上尝试。马特尔说,磁性颗粒可以包裹其他靶向颗粒。“我们建造了一辆卡车,我们有一个 GPS 系统,”他说。“你可以将任何东西装入卡车。”
研究人员驾驶药物直接到达肿瘤部位的愿景与玛丽·戴维斯近 20 年前经历的全方位攻击截然不同。今天,她鼓励丈夫开发的药物即将结束 II 期临床试验,并已用于治疗数百名患者。马克·戴维斯说,未来的疗法可能会更有效,副作用更少。“我们需要考虑降低癌症影响的方法,这样人们就可以在没有所有额外副作用和毒性的情况下过上合理的生活。”
本文经许可转载,并于 2014 年 5 月 28 日首次发表。
