没有人预料到斑点的接管。2009年,由德国德累斯顿马克斯·普朗克分子细胞生物学和遗传学研究所的安东尼·A·海曼领导的一个生物物理学家团队,正在研究一种微小的土壤蠕虫单细胞胚胎中称为P颗粒的斑点状结构。众所周知,这些斑点只聚集在细胞的一端,使其变得不对称,这样当细胞分裂时,两个子细胞是不同的。研究人员想知道P颗粒的不均匀分布是如何产生的。
他们发现,这些由蛋白质和RNA组成的斑点,像潮湿空气中的雨滴一样在细胞的一侧凝结,又在另一侧溶解。换句话说,颗粒的分子成分正在经历相变,就像将物质在液态和气态之间切换一样。
这在细胞生物学中发生是一件奇怪的事情。但起初,许多研究人员认为这只不过是一个怪癖,并没有引起太多关注。然后,这些小斑点——现在被称为生物分子凝聚物——开始在研究人员观察细胞的几乎任何地方出现,执行着无数重要的任务。
支持科学新闻
如果您喜欢这篇文章,请考虑通过以下方式支持我们屡获殊荣的新闻报道 订阅。 通过购买订阅,您正在帮助确保有关塑造我们当今世界的发现和想法的具有影响力的故事的未来。
生物学家长期以来一直认为,将秩序和组织带入细胞内分子的混乱状态取决于称为细胞器的膜结合区室,例如线粒体。但事实证明,凝聚物提供了“免费的秩序”,而无需膜。它们提供了一种简单、通用的组织方式,细胞可以开启或关闭。德国马丁斯里德马克斯·普朗克生物化学研究所的生物物理学家佩特拉·施维勒解释说,这种安排允许生命赖以生存的许多事物。
现在看来,活细胞内的这些小斑点遍布生物世界的各个领域,并且“与细胞功能的几乎每个方面都相关”,生物物理工程师克利夫·布兰温尼说,他是2009年德累斯顿团队的成员,现在在普林斯顿大学经营自己的实验室。它们保护细胞免受危险的高温或低温;它们修复DNA损伤;它们控制DNA转化为关键蛋白质的方式。当它们出现问题时,它们可能会引发疾病。
生物分子凝聚物现在似乎是生命如何使其无数分子成分协调和合作,形成委员会,对我们生存所依赖的群体决策做出关键部分。“细胞生物学的最终问题不是如何将几个拼图碎片拼凑在一起,”布兰温尼说,“而是数十亿个拼图碎片的集合如何在大尺度上产生涌现的、动态的结构。”
德累斯顿技术大学的生物物理学家西蒙·阿尔贝蒂说,这些无处不在的斑点“完全接管了细胞生物学”。现在的挑战是了解它们是如何形成的,它们做什么——也许是如何控制它们以设计新的医疗疗法和治愈方法。
最初,研究凝聚物的研究人员认为它们是通过凝聚形成的,就像一种液相在另一种液相中变得不溶一样——就像沙拉酱油中的醋滴。但凝聚物并不总是简单的相分离液体。
2012年,达拉斯德克萨斯大学西南医学中心的生物物理学家迈克尔·罗森和他的同事表明,各种蛋白质和RNA分子可以从溶液中相分离成致密的液滴,然后凝结成粘弹性物质。它们似乎跨越了从粘稠的液体(如粘液)到几乎固体的凝胶(如果冻)的范围。或者,正如圣路易斯华盛顿大学的生物物理学家罗希特·帕普所描述的那样,“所有的凝聚物都是橡皮泥。”
“生物分子凝聚物”这个总称,由海曼、罗森及其同事在2017年提出,使这些无处不在的斑点与它们都是液体的早期概念区分开来。
现在看来,凝聚物是生命如何使其无数分子成分协调的关键部分。
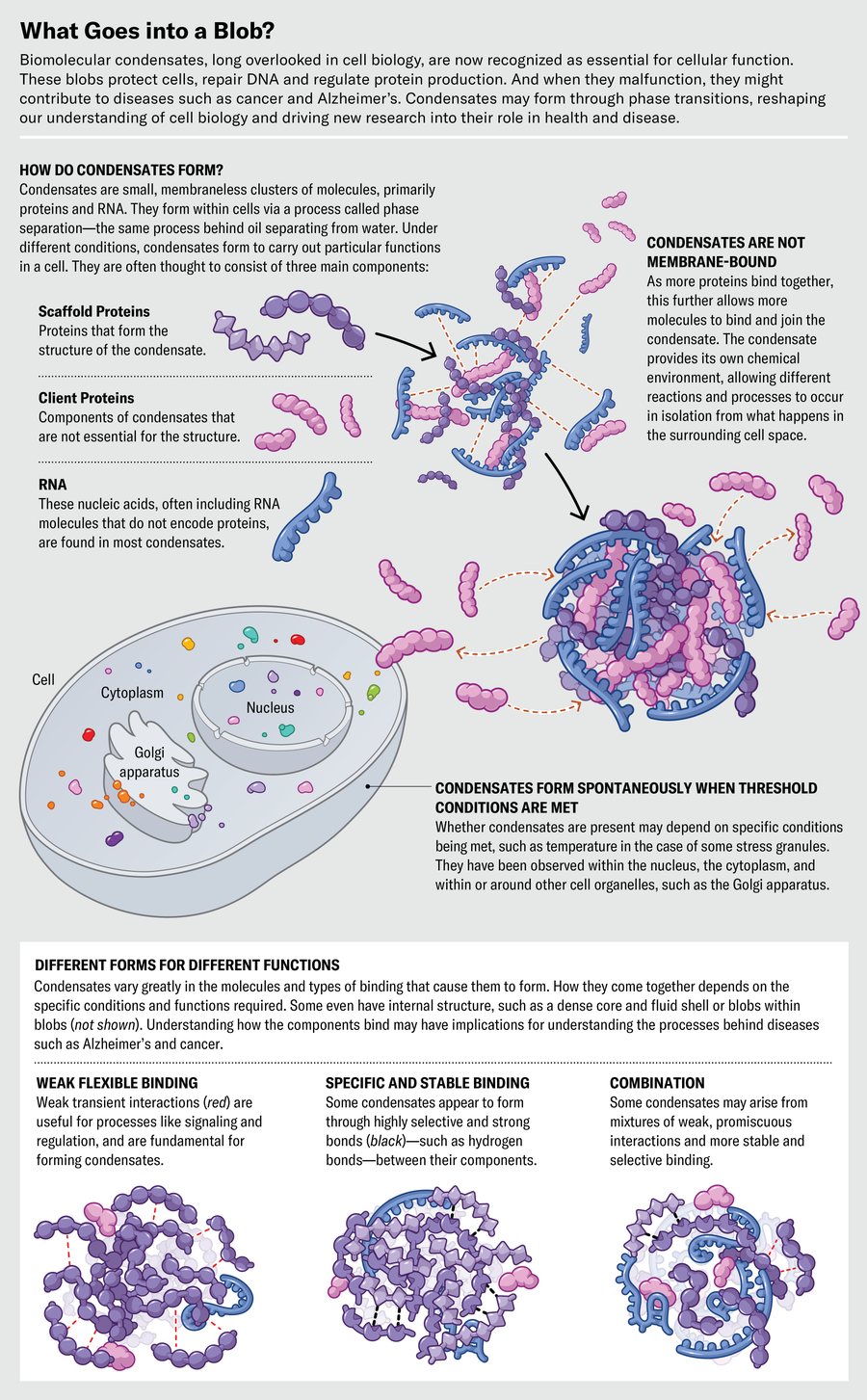
与生物化学家和分子生物学家习惯研究的精确分子结合相比,凝聚物看起来可能很混乱。它们不是静态形式,而是分子会合场所,通常是几种不同成分的松散集合,其中一些成分可以进入或离开斑点。其中一些成分,称为支架分子,对结构至关重要,粘合在一起形成凝胶状网络。另一些成分,有时被称为客户分子,只是在网络中闲逛。然而,这两种类型似乎都可以在不使凝聚物解体的情况下来回移动。
通常,凝胶包含蛋白质和RNA分子。蛋白质的原型形象是一种酶,由氨基酸链紧密折叠成球状物制成。但凝聚物中许多蛋白质的部分更开放和松散(像煮熟的意大利面),或者生物化学家称之为内在无序区域。
这种形成凝聚物的蛋白质通常似乎有粘性斑块,例如,链携带电荷,可以相互吸引,通过无序和柔性的间隔区段连接在一起。与蛋白质(如酶)紧密且非常选择性地结合其他分子的传统观点不同,内在无序蛋白质的相互作用可能相当弱且混杂:它们在结合对象时不太挑剔。
许多凝聚物的另一种成分是RNA分子,它也是带有电荷的长链。长期以来,RNA主要被认为是作为中间体,将信息从基因传递到核糖体的机器,核糖体将其翻译成蛋白质链的氨基酸序列。但形成凝聚物的RNA通常是不同家族的成员:非编码RNA,它们不仅仅是制造蛋白质的信使,而且本身就是目的。
同时,凝聚物中的一些蛋白质属于一个家族,其工作似乎是结合RNA。通过调整蛋白质和RNA序列和结构以改变它们的结合倾向,生物学具有用于改变凝聚物功能或它们形成条件的旋钮。
例如,当酶用其他化学基团(如带电的磷酸盐)修饰蛋白质时,可能会将蛋白质切换到形成凝聚物的模式,从而改变它们的形状和粘性。或者,当细胞开始合成组成RNA时,可能会召唤这些斑点。例如,当我们自己的细胞制造一种称为NEAT1的非编码RNA时,似乎就会发生这种情况,NEAT1是称为核旁斑的凝聚物的支架,在调节基因中起作用。
奇怪的是,科学家们早在知道活细胞时就已经有了凝聚物存在的证据——他们只是不知道该如何理解它们。早在1830年,早期的显微镜学家就在细胞核内看到了神秘的斑点。它们当时被称为核仁,后来被发现是核糖体制造的地方。但直到2011年,布兰温尼、海曼和哈佛医学院的资深细胞生物学家蒂姆·米奇森才阐明了核仁实际上是什么:相分离的液滴。
这些特殊的斑点有很多工作要做。似乎它们有助于控制核糖体组装的所有许多步骤——由许多蛋白质和RNA片段组成。布兰温尼和其他人已经表明,液态核仁(一种凝聚物)被细分为几个具有不同成分的同心层,就像鸡蛋的壳、蛋白和蛋黄一样。“这种分层凝聚物允许不同处理步骤的空间隔离,”他解释说。
现在医学工作室
除了核仁外,凝聚物还与细胞的其他长期公认的区室和细胞器相关联。其中之一被称为高尔基体:细胞核附近的一组堆叠的带状脂质膜,充当蛋白质和其他分子的一种分拣中心。达拉斯德克萨斯大学西南医学中心的张艺云和约阿希姆·西曼已经表明,当细胞受到压力时,这些带状物由一种称为GM130的蛋白质形成的凝聚物来维持或修复。
该蛋白质在高尔基体膜上创建一个基质,然后将RNA和RNA结合蛋白聚集到液相中,这有助于将膜粘合成堆叠。然而,在压力条件下,蛋白质和RNA分离,凝聚物解体,带状物开始瓦解。然后,释放的GM130与RNA聚集形成凝聚物“应激颗粒”,将其储存起来,以便在压力过去后将膜重新粘合在一起。
这只是凝聚物如何帮助细胞度过困难时期的一个例子。一种常见的压力源是热,它会导致折叠的蛋白质“变性”或解开。许多细胞在变得不舒服地温暖时会产生热休克蛋白,它可以充当分子伴侣,引导变性蛋白质回到其折叠状态。这很重要,不仅是为了使蛋白质正常工作,而且是为了防止未折叠的蛋白质粘在一起形成粘稠的混乱。
但芝加哥大学的生物化学家D·艾伦·德拉蒙德认为,这种图景总是有点不对劲。这意味着,如果细胞变得太热并且需要制造热休克蛋白,它们只有在损伤已经发生时才能感觉到。“这闻起来就不对劲,”他说。
相反,德拉蒙德怀疑细胞感知温度——和其他形式的压力——的方式是通过凝聚物形成。2017年,他和他的同事发现,酵母细胞中出现的应激颗粒,包含由一种称为Pab1的RNA结合蛋白组成的凝聚物。当这种蛋白质被束缚在凝聚物中时,它会失去大部分结合编码伴侣蛋白的信使RNA分子的能力,而伴侣蛋白是保护细胞免受热休克所需的。
当研究人员将突变引入编码Pab1的基因时,他们可以改变由此产生的蛋白质形成凝聚物的倾向,因此当变暖时,具有该突变的细胞表现不佳。因此,德拉蒙德认为,凝聚物形成——在特定阈值(例如,温度)突然发生的相变——本身就是压力传感器,它警告细胞问题并引发反应。“你将凝聚物添加到图中,你彻底改变了你对此的思考方式,”他说。
对细胞的另一种常见威胁是DNA损伤,例如,由暴露于紫外线或环境毒素引起。阿尔贝蒂的研究小组发现,凝聚物可以充当超强胶水,将受损的DNA链固定在一起,同时酶修复它们。
长期以来,人们都知道DNA修复涉及一种称为PARP1的蛋白质,在2024年初,阿尔贝蒂的团队报告说,这种分子沿着DNA链移动,直到找到断裂,然后它与DNA聚集成凝聚物,保护损伤免受细胞核其余部分的侵害。“这种胶水非常牢固,”阿尔贝蒂说。然后,一种称为FUS的蛋白质被掺入胶水斑点中并使其软化,以便其他酶可以在凝聚物内工作,将链的末端重新连接在一起。由于DNA损伤对细胞可能是致命的,因此靶向癌细胞中PARP1并通过将胶水固定在其“固体”形式来阻止DNA修复的药物可能会杀死它们。
组织复杂的生化过程和对应激的反应是凝聚物的两个常见功能。帕普、他的同事戴一凡和他们的同事最近发现了另一个功能:凝聚物可以充当生化反应的催化剂,即使它们的组成蛋白质不充当催化剂。这是因为凝聚物在两相之间创建了一个界面,从而在浓度上建立了一个梯度——例如,离子的浓度梯度,产生一个可以触发反应的电场。研究人员已经证明了凝聚物诱导的广泛生化反应的催化作用,包括涉及水解的反应(其中水将其他分子分裂开来)。
凝聚物也可能在生物学中最重要的过程之一中发挥作用:基因如何被调节以确定它们是否产生相应的蛋白质。在人类等复杂生物中,转录的初始过程——DNA中的基因被读取以制造模板蛋白质的mRNA分子——是一个令人费解的复杂事件。它涉及许多参与者:基因本身以外的DNA区域,如增强子(通常位于链的相当遥远的部分)、称为转录因子的蛋白质(与DNA结合)、RNA制造酶等等。
所有这些成分如何聚集在一起并达成群体决策以调节转录仍然不清楚。“当我从物理学过渡到生物学时,”帕普说,“我会坐在那里[在会议上]听这些基因调控的演讲——这激活了这个,这个招募了那个——我总是在想:‘这些分子是在互相打电话吗?到底是怎么回事?’”
似乎凝聚物状聚集体可能是将这些成分聚集在细胞核DNA缠结中的原因。DNA链本身可能充当这种液滴的种子,就像大气中的尘埃颗粒播撒云滴的凝结一样。这个斑点可以吸入DNA环上的远处增强子区域,同时聚集所有其他需要的分子,并阻止它们漂移开来。
转录过程中的分子聚集比许多其他凝聚物中的分子聚集要小得多,并且很难在活细胞核内清楚地看到它们。因此,关于这种“转录中心”是否是真正的液滴,以及凝聚物形成是该过程的必要组成部分还是副作用,仍然存在争议。德拉蒙德提出的另一种可能性是,所有这些分子一旦聚集到同一空间,就会组合成一个更有序的复合物来启动转录,但它们的聚集也会产生凝聚物。
还有很多东西需要解开。“我告诉人们,我所知道的是,这些[转录]蛋白质真的想要相分离,”布兰温尼说。“我只是看不到另一种合理的模型。相分离是最简约的解释。”
蛋白质聚集成致密的斑点似乎是生命运作方式的一个基本方面。但这个过程也有阴暗面。
长期以来,蛋白质缠结团块一直与神经退行性疾病(如帕金森病和阿尔茨海默病)有关。这些固体状结节,称为淀粉样蛋白,可能对细胞有毒并杀死神经组织。一些研究人员怀疑,这种有问题的蛋白质聚集体可能是由于对普遍存在的、短暂的凝聚物的不当控制而产生的,例如,由于基因突变以使其成分蛋白质易于凝结成长寿命固体肿块的方式影响它们。
起初,研究人员的口头禅是“液体好,固体坏”——但这显然过于简单化,因为健康的凝聚物具有一系列材料特性,其中可能包括固体状。现在,真正区分“好”凝聚物和“坏”凝聚物的是该领域迫切需要解决的问题之一。
人们正在探索凝聚物与病理性淀粉样蛋白之间可能的联系,以寻找治疗神经退行性疾病的方法。反义寡核苷酸——可以与RNA结合的核酸短片段——可能被用来抑制与这些疾病相关的蛋白质的聚集。人们也在探索使用它们来禁用形成凝聚物的RNA分子。
同样,凝聚物(如核旁斑)在基因调控中的重要性意味着它们的失调可能导致各种疾病,包括癌症。现在,由初创公司Dewpoint Therapeutics(由海曼、麻省理工学院的生物学家理查德·扬和诺贝尔奖获得者菲利普·A·夏普共同创立)和Nereid Therapeutics(建立在布兰温尼的工作基础上)正在追求一个新兴的凝聚物疗法领域,这两家公司都位于波士顿。“正在取得大量进展,”布兰温尼说。“凝聚物生物物理学现在正在将药物推向临床试验。”
到目前为止,大多数注意力都集中在神经退行性疾病和癌症的治疗上,但也正在努力通过凝聚物对抗病毒感染。一些病毒似乎“劫持”了形成凝聚物的蛋白质,以帮助它们复制——因此靶向这些凝聚物可能会阻止病毒。2021年,法国和中国的研究人员表明,一种使病毒诱导的称为包涵体的凝聚物更固态化的药物可以破坏人类呼吸道合胞病毒RSV的感染。
2023年,当布兰温尼和海曼因其工作获得300万美元的突破奖时,这无疑是凝聚物已经到来的信号。“未来10年将会有很多很酷的东西,”阿尔贝蒂说。虽然关于生物分子凝聚物仍有许多问题,但在德拉蒙德看来,这些斑点是“我们一直期待的革命”。
似乎很奇怪,花了这么长时间才认识到凝聚物的真实面目。至少部分答案是它们不符合已经流行了几十年的分子生物学图景。旧的范式完全是关于分子如何通过选择性相互作用(紧密编码在其结构中)在细胞周围传递信息。凝聚物破坏了这种观点。它们是松散的、短暂的和灵活的,它们表明细胞的许多关键过程是使用由数百名成员组成的分子委员会进行的。
施维勒怀疑,通过凝聚物实现分子组织可能在生命本身的起源中至关重要,那时核酸和蛋白质尚未进化到具有精确定义的结构。首先,它们展示了细胞样区室如何通过液相分离从这些聚合生物分子的祖先中自发形成。
事实上,1929年,两位荷兰化学家报告了这样的蛋白质斑点,他们称之为凝聚层,几年后,俄罗斯生物化学家亚历山大·奥巴林将其称为最早的原始“原生细胞”。施维勒说,这样的区室通过将一些分子与其他分子隔离,可以建立浓度梯度,从而维持生物体在非平衡状态下的生存。
帕普推测,在蛋白质本身能够充当酶之前,催化凝聚物可能在这样的原生生命实体中很重要。阿尔贝蒂说,未来的重大问题之一是进化随后如何利用凝聚物。自然选择的力量如何作用于所有分子参与者,以改变和调整它们形成凝聚物的能力?“研究它将会非常有趣,”阿尔贝蒂说。“你必须将进化生物学与物理学结合起来。”
然而,目前,凝聚物标志着我们对生命如何在分子尺度上运作的理解进入了一个新阶段。“我们现在意识到,[传统的]生物化学和结构生物学不足以描述细胞中正在发生的事情,尤其是当我们处理涉及许多成分的过程时,”阿尔贝蒂说。我们需要了解所有这些成分如何协调它们的相互作用,以创造出作为统一实体的细胞。
这些斑点揭示了一个重要的尺度,协调发生在这个尺度上:介于多组分复合物(如染色体)的大小和整个细胞的大小之间。这是一个分子不再像精密的小机器一样工作,而是聚集到一种物质实体中的尺度,这种实体受相变的集体物理学支配,但仍然对它们的分子成分的细节敏感。我们尚不清楚支配这些尺度上发生的事情的规则。但比以往任何时候都更清楚的是,生命依赖于它们。