1907年,德国精神病学家阿洛伊斯·阿尔茨海默发表了一份关于一种影响大脑皮层的不寻常疾病的病例报告。一位居住在美因河畔法兰克福一家精神病院的51岁妇女表现出的症状,对于数百万受如今被称为阿尔茨海默病影响的家庭来说,都太熟悉了。症状包括记忆丧失、意识模糊和迷失方向。
患者去世后,阿尔茨海默检查了她的大脑,并做出了一些关键观察。首先,它比平均水平小,或称萎缩,并伴有相应的神经元损失。其次,神经元内部存在蛋白质纤维缠结,脑细胞外部存在另一种蛋白质沉积。在接下来的100年中,这两种病理性蛋白质——被称为 tau 蛋白和淀粉样蛋白——一直是阿尔茨海默病病因研究的重点。
但阿尔茨海默在尸检中注意到一个额外的、经常被遗忘的线索。在显微镜镜头下,他看到了某些非神经元细胞结构组成的明显变化。这些细胞被称为神经胶质细胞,约占大脑细胞的一半。
支持科学新闻事业
如果您喜欢这篇文章,请考虑通过以下方式支持我们屡获殊荣的新闻事业: 订阅。通过购买订阅,您正在帮助确保有关塑造我们当今世界的发现和思想的具有影响力的故事的未来。
自阿尔茨海默发现以来,神经胶质细胞仅受到少数科学家的研究,现在已成为关注焦点。其中一种称为小胶质细胞的细胞是大脑中主要的免疫细胞类型,可能在疾病的早期和晚期以不同的方式影响疾病的进展。小胶质细胞也可能解释淀粉样蛋白和 tau 蛋白之间复杂的关系,这两种异常蛋白会导致神经元退化和记忆丧失。
过去十年的研究已经确定了新的分子风险因素,这些因素表明这些大脑免疫细胞与阿尔茨海默病有关。在强大的基因测序方法的指导下,我们开始了解小胶质细胞以及免疫系统及其炎症过程在阿尔茨海默病中的作用。
尽管我们已经了解了很多关于 tau 蛋白和淀粉样蛋白的生物化学,以及一些可能影响一个人患阿尔茨海默病风险的遗传和生活方式因素,但几乎没有可以阻止或减缓疾病进展的治疗方法。6 月 7 日,美国食品和药物管理局批准了一种新药 aducanumab,它可以清除大脑中的淀粉样蛋白。但尚不清楚它在改善患者日益衰退的认知技能方面的效果如何。仍然需要更多的干预措施。最近关于小胶质细胞的见解提出了潜在的阿尔茨海默病新疗法,目前正在开发几种疗法,其中一些已经进入临床试验阶段。
斑块、缠结和基因
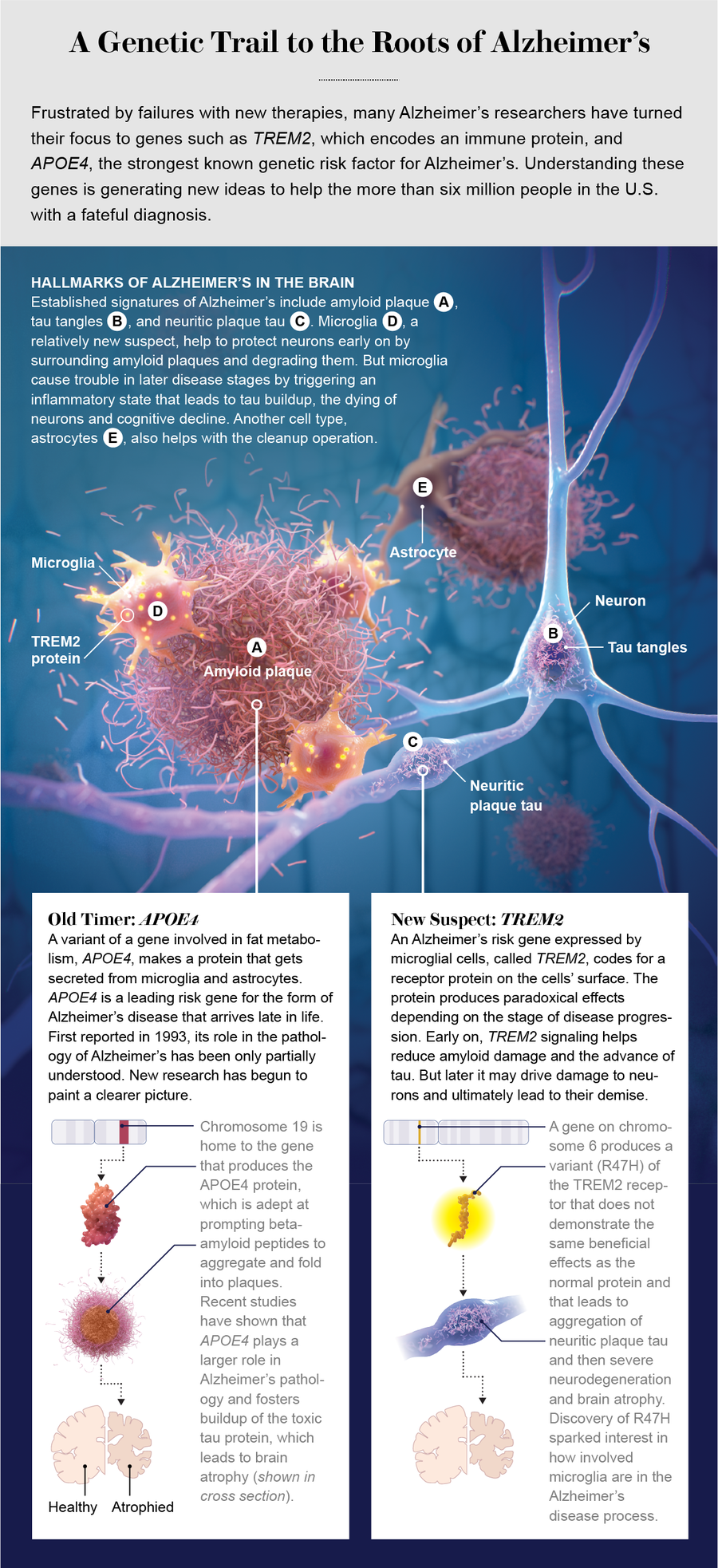
阿尔茨海默病是全球痴呆症的主要原因,其多种病理会在数十年内积累和汇聚。阿尔茨海默病有两个独特的分子特征。第一个是斑块,由一种称为 β-淀粉样蛋白的淀粉样蛋白组成。这些肽,或小蛋白质,存在于细胞之间的空间中。
第二个是 tau 蛋白的扭曲或错误折叠形式,大量的磷酸基团附着在其上,这个过程称为过度磷酸化。tau 蛋白磷酸化的增加与蛋白质聚集和毒性的增加有关。tau 蛋白以扭曲的团块形式存在于神经元的细胞体中,称为神经原纤维缠结。一些 tau 蛋白也会出现在淀粉样蛋白斑块附近肿胀、受损的轴突中,轴突是从神经元主体延伸出来的长突起。这种形式被称为神经炎性斑块 tau 蛋白。
tau 蛋白和淀粉样蛋白的较大前体蛋白在细胞功能中都具有正常作用,但在阿尔茨海默病患者的疾病过程中会被破坏。为了解淀粉样蛋白和 tau 蛋白的病理形式所做的广泛努力,使我们得出结论,我们应该将阿尔茨海默病分为两个阶段。第一阶段是 15 至 25 年的症状前阶段,在此期间淀粉样蛋白在大脑最外层大脑皮层中积聚,但没有认知症状。在第二阶段,tau 蛋白缠结在大脑皮层中发展,神经退化开始,随着脑细胞死亡,认知功能障碍出现。
阿尔茨海默病研究界已经知道几十年了,遗传风险因素强烈影响一个人患阿尔茨海默病的可能性,基因为理解疾病的潜在机制提供了宝贵的见解。与阿尔茨海默病相关的最主要风险基因是 APOE。它编码载脂蛋白 E,该蛋白参与脂肪和胆固醇代谢。(基因的字母数字名称通常用斜体表示,而它们编码的蛋白质的名称则以常规文本形式呈现。)
该基因与阿尔茨海默病的关联,最早于 1993 年报道,与该基因的一个版本有关,称为等位基因,它会显著增加患病风险。人类群体中三种常见的 APOE 等位基因是 APOE2、APOE3 和 APOE4。APOE3 是最常见的,约占所有等位基因的 78%,其次是 APOE4,约占 14%,APOE2 约占 8%。每个人都有两个 APOE 等位基因,约 25% 的人携带至少一个 APOE4 等位基因。但在阿尔茨海默病患者中,约 60% 的人携带至少一个 APOE4 等位基因。
携带单个 APOE4 等位基因的人患阿尔茨海默病的风险增加三到四倍,而携带两个 APOE4 副本的个体患病风险比携带两个 APOE3 等位基因的人高约 12 倍。APOE4 携带者更早且更大量地沉积淀粉样蛋白斑块,因为他们的载脂蛋白 E 版本会减少 β-淀粉样蛋白从大脑中的清除,并促进蛋白质的聚集。相反,APOE2 携带者患阿尔茨海默病的风险较低,并且不太可能发展出淀粉样蛋白病理。
尽管 APOE4 的影响很强,但它并不能解释阿尔茨海默病的所有遗传易感性。遗传学家一直在不懈地寻找可能解释这种“缺失的遗传性”的其他风险因素,利用基因测序技术的进步来筛查数千人 DNA 的变化,这些变化与患阿尔茨海默病风险的升高或降低有关。
大规模筛查已经确定了似乎影响疾病风险的遗传区域和基因。其中包括基因变异体——CD33、BIN1、CR1 和 MS4A6A——它们编码具有各种功能的蛋白质。例如,CD33 和 CR1 为细胞表面的受体提供遗传指令,这些受体检测来自其他细胞的信号。通过人群筛查发现的这些基因对疾病风险的影响相对较小。
研究人员还对数千名阿尔茨海默病患者的基因组进行了测序,以寻找可能对疾病风险产生强烈影响的罕见变异。其中一些风险基因主要由小胶质细胞表达,小胶质细胞是大脑中主要的免疫细胞。2013 年,两项研究确定了 TREM2 中的一种罕见变异,TREM2 是一种编码穿过小胶质细胞膜的受体的基因,该变异会显著增加患阿尔茨海默病的风险。
测序数据揭示了一种变异,该变异用称为组氨酸的氨基酸取代了精氨酸。发现这种突变会损害小胶质细胞的功能,并将患阿尔茨海默病的风险增加约两到四倍。有趣的是,与其他几种新的风险因素基因一样,TREM2 仅在大脑中的小胶质细胞中表达。这些遗传线索表明,小胶质细胞可能积极地参与疾病过程,但如何参与呢?
监视小组
小胶质细胞与称为巨噬细胞的免疫细胞有关,巨噬细胞在体内巡逻以对抗病原体或帮助修复受损组织。研究人员正在了解到,它们参与从抵抗感染到修剪发育中的大脑中多余的突触(神经元相遇的连接点)的方方面面。在正常情况下,小胶质细胞具有小的细胞体,其分支状突起延伸遍布脑组织。这些免疫细胞吞噬——或更正式地说,是胞吞作用——不需要的突触和碎片,并寻找损伤或病原体入侵的迹象。
如果确实发生损伤,小胶质细胞的形状和功能会发生变化。细胞体变大,从细胞体延伸出的分支变短且数量减少。小胶质细胞迁移到损伤部位以启动炎症反应。几十年来,研究人员观察到淀粉样蛋白斑块周围的小胶质细胞。然而,尚不清楚它们是帮助限制淀粉样蛋白的积累,还是启动有毒的炎症。小胶质细胞和 tau 蛋白之间的关系也知之甚少。
一些研究表明,小胶质细胞作用于神经元以损害轴突和突触,阻碍沿轴突传输的信号,并导致细胞中 tau 蛋白的积累。
其他研究表明,小胶质细胞分泌的称为细胞因子的炎症蛋白显著增加了过度磷酸化的破坏性过程。TREM2 和 CD33 等遗传风险因素的发现指出了小胶质细胞中可能与阿尔茨海默病有关的不同分子。研究人员希望了解这些蛋白质的功能将有助于深入了解这些细胞在疾病过程中发挥的更广泛的作用。
致谢:AXS 生物医学动画工作室
实验小鼠是研究遗传因素如何影响人类阿尔茨海默病痴呆症中观察到的大脑变化的宝贵工具。到目前为止,很少有实验动物能够重现阿尔茨海默病的所有方面(例如,淀粉样蛋白斑块积聚,然后是病理性 tau 蛋白的扩散以及伴随的神经退化的小鼠)。但研究人员已经创建了数十个“模型”——基因工程小鼠,它们会发展出淀粉样蛋白斑块或 tau 蛋白。
通过将这些转基因小鼠与经过基因工程改造以表达阿尔茨海默病风险基因改变的小鼠杂交,研究人员可以确定基因变异如何影响阿尔茨海默病样病理的不同方面。例如,二十年前,经过基因工程改造以表达人 APOE4 蛋白的淀粉样蛋白小鼠模型被证明比具有 APOE3 或 APOE2 基因变异的小鼠发展出更多的淀粉样蛋白斑块。近年来,研究人员通过删除淀粉样蛋白病理小鼠模型中的 Trem2 基因,评估了人 TREM2 蛋白在阿尔茨海默病中的作用。几个实验室一致地发现,在这些小鼠中,淀粉样蛋白斑块周围的小胶质细胞数量急剧减少。
圣路易斯华盛顿大学马可·科隆纳实验室的一系列研究发现,在没有 Trem2 基因的小鼠中,小胶质细胞无法适当地提高其新陈代谢。当靠近淀粉样蛋白斑块时,它们没有产生足够的腺苷三磷酸 (ATP),ATP 是一种为细胞活动提供能量的分子。由于能量匮乏,细胞无法包围淀粉样蛋白斑块。然后,研究人员观察到肿胀的、受损的轴突增加,称为营养不良性神经突触,这是由淀粉样蛋白造成的损害引起的。
这些关键观察结果——斑块周围的小胶质细胞较少以及轴突损伤增加——也在患有阿尔茨海默病且具有 TREM2 基因罕见突变(称为 R47H,即 2013 年发现的突变)的人的死后脑切片中观察到。这一发现增强了人们的信心,即在小鼠中观察到的结果可能与 TREM2 在人体中的作用有关。此外,耶鲁大学杰米·格鲁岑德勒小组的工作表明,包围斑块的小胶质细胞越少,附近轴突受到的损害就越大。
该研究进一步证明了小胶质细胞在保护局部区域免受斑块周围淀粉样蛋白毒性作用的潜在作用。它还表明,小胶质细胞与微小的淀粉样蛋白纤维末端相互作用,可能阻止其生长或保护周围神经元免受淀粉样蛋白的不良影响。
有毒种子
如果小胶质细胞保护轴突免受淀粉样蛋白斑块损害,它们是否也能防止 tau 蛋白病理?如果是这样,危险的 TREM2 突变(如 R47H)可能会使神经炎性斑块 tau 蛋白更容易在淀粉样蛋白斑块附近发展,从而加剧阿尔茨海默病病理。检验这一假设仍然具有挑战性,但一些线索来自探索 tau 蛋白病理如何像朊病毒一样传播的研究,朊病毒是克雅氏病等疾病的特征,其中一种形式与“疯牛病”有关。
在过去十年左右的时间里,研究人员发现 tau 蛋白和淀粉样蛋白折叠成类似于朊病毒样“种子”的异常形状,然后导致正常结构的蛋白质也发生错误折叠。通过这种方式,病理性 tau 蛋白可以随着阿尔茨海默病的进展传播到相连的脑区。宾夕法尼亚大学弗吉尼亚·曼-伊·李实验室发表的一系列论文表明,将从阿尔茨海默病病理大脑中分离出来的聚集 tau 蛋白种子注射到正常小鼠大脑中,会导致小鼠 tau 蛋白错误折叠成神经原纤维缠结。已经患有淀粉样蛋白病理的小鼠发展出神经炎性斑块 tau 蛋白,即损害轴突形式的蛋白质。后一个过程类似于阿尔茨海默病中的一系列事件。尽管小鼠没有发生明显的神经退化,“播种”方法为研究淀粉样蛋白和 tau 蛋白病理提供了一种可靠的方法。
当 tau 蛋白不参与阿尔茨海默病病理时,它通常位于神经元的轴突中,在那里它有助于稳定称为微管的结构蛋白,微管有助于将细胞物质从神经元的一部分运输到另一部分。李的团队发现,淀粉样蛋白斑块附近肿胀轴突中的 tau 蛋白与微管脱离,使其可能更容易发生扭曲。本质上,这些受损的轴突变成了肥沃的土壤,周围富含淀粉样蛋白皮层的病理性 tau 蛋白种子可以在其中生根发芽。
由于小胶质细胞上具有破坏性的 R47H 突变型 TREM2 蛋白会增加轴突损伤,我们推断,更常见的 TREM2 形式可能有助于免疫细胞屏蔽淀粉样蛋白斑块附近的轴突,防止 tau 蛋白种子刺激进一步的 tau 蛋白积累或侵入大脑皮层的其他区域。在我们实验室当时的成员谢丽尔·莱恩斯和莫德·格拉图兹领导的一项研究中,我们将来自阿尔茨海默病大脑的 tau 蛋白种子注射到表达和不表达功能性 TREM2 蛋白基因的小鼠模型中,发现没有该蛋白的小鼠在肿胀的轴突中发展出更多的神经炎性斑块 tau 蛋白。这种损害通过相连神经元的网络传播到大脑的其他区域。
我们还使用了科隆纳开发的小鼠模型,该模型表达正常人 TREM2 或 R47H 形式。同样,当注射 tau 蛋白种子时,具有 R47H 变异的淀粉样蛋白小鼠模型在淀粉样蛋白斑块附近发展出更多的神经炎性斑块 tau 蛋白病理。为了证实来自小鼠模型的发现,我们还检查了人脑,发现患有阿尔茨海默病相关 TREM2 变异的人有更多的神经炎性斑块 tau 蛋白。从这些观察结果中,我们得出结论,正常 TREM2,或许还有一般的小胶质细胞,可以防止淀粉样蛋白诱导的 tau 蛋白播种和tau 蛋白在大脑中的扩散。
在阿尔茨海默病第一阶段典型的富含淀粉样蛋白的皮层中,小胶质细胞似乎可以防止 tau 蛋白病理的扩散。但是,一旦神经原纤维缠结在大脑皮层中发展并且神经退化在疾病的症状期开始,它们是否仍然具有保护作用?两项有影响力的研究——一项来自以色列雷霍沃特魏茨曼科学研究所伊多·阿米特实验室,另一项来自布莱根妇女医院奥列格·布托夫斯基及其同事——研究了不同神经退行性疾病小鼠模型中小胶质细胞基因活性的变化,并发现了这些基因如何被激活的显著相似之处。
他们发现,在具有类似于 tau 蛋白病理发生的神经退行性损伤的小鼠大脑中,小胶质细胞开启了多种基因,其中许多基因编码用于降解细胞中不需要物质的蛋白质。此时,小胶质细胞强烈增加了小鼠版本 APOE4 风险基因的表达。看来 APOE 和 TREM2 在决定神经元开始死亡和症状首次出现时是否激活小胶质细胞反应方面都起着关键作用。
这一发现促使我们将表达不同版本人 APOE 的小鼠与同时发展出 tau 蛋白病理和严重神经退化的小鼠模型杂交。在我们圣路易斯华盛顿大学实验室杨石领导的一项研究中,我们发现表达 APOE4 的 tau 蛋白小鼠模型比 APOE3 或 APOE2 小鼠具有更多的神经退化和更晚期的 tau 蛋白病理。接下来,我们评估了患有阿尔茨海默病或其他具有大量 tau 蛋白积累的神经退行性疾病的人的细胞死亡情况。我们发现,APOE4 携带者比携带其他等位基因的人遭受更大的大脑损伤。
此外,APOE4 携带者的阿尔茨海默病患者比非 APOE4 携带者的患者病情恶化得更快。这对我们和其他研究人员来说是一个惊喜,因为多年来,人们一直认为 APOE4 的主要作用是大量淀粉样蛋白的积累。然而,这些研究表明,APOE4 不仅在调节淀粉样蛋白病理中发挥作用,而且还在决定神经元对 tau 蛋白病理反应的死亡速度中发挥作用。这意味着“阿尔茨海默病基因”(APOE4 的别称)不仅影响淀粉样蛋白沉积,还影响因 tau 蛋白积累而导致的神经损伤,这两个是主要的疾病阶段。
对 APOE4 不断深入的了解促成了下一个小鼠实验。我们发现,删除小鼠版本的 APOE 基因对神经退化具有很强的保护作用,并延缓了 tau 蛋白病理的进展——更重要的是,延缓了 tau 蛋白积累引起的大脑损伤。如果删除 APOE 基因在小鼠模型中具有神经保护作用,那么或许降低人脑中 APOE 水平可以减缓神经退化,尤其是在携带 APOE4 变异的人中。
在另一项实验中,我们使用了 tau 蛋白小鼠模型,该模型也表达人 APOE4,以测试降低载脂蛋白变异体的水平是否可以防止神经退化。我们与 Ionis Pharmaceuticals 合作,使用反义寡核苷酸(修饰 DNA 的短片段,可以降解信使 RNA(细胞制造特定蛋白质的分子指令)),将小鼠大脑中 APOE4 的含量降低一半。我们发现,当 tau 蛋白病理开始扎根时,降低 APOE4 水平可以保护神经元,并减少小鼠大脑中的炎症和小胶质细胞激活。
一个新兴的图景表明,小胶质细胞在阿尔茨海默病痴呆症的进展过程中发挥着两种不同的作用。在淀粉样蛋白病理的小鼠模型中,斑块周围小胶质细胞活性的增加似乎可以保护大脑。在 tau 蛋白病理的小鼠中,异常 tau 蛋白强烈增加了与神经退化相关的小胶质细胞基因的表达,而 APOE4 似乎进一步加剧了大脑的炎症。所有这些都表明小胶质细胞对 tau 蛋白病理产生了强烈的免疫反应,这种反应与损害的增加有关,而不是对大脑的保护。
当然,相关性并不等同于因果关系,在我们研究的那个阶段,尚不清楚在表达 APOE4 的 tau 蛋白模型中观察到的强烈免疫反应是驱动了退化,还是仅仅是对退化的一种反应。接下来,我们询问小胶质细胞表面受体 TREM2 的缺失是否会增加大脑中的神经退化和炎症。如果小胶质细胞有助于保护神经元,即使在疾病的相对晚期,这也不会完全令人惊讶。
再一次,降低基因活性的实验正在进行中。敲除 tau 蛋白小鼠模型中的 TREM2 降低了小胶质细胞的反应,并降低了神经退化水平。这一发现表明,降低小胶质细胞活性导致 tau 蛋白病理造成的损害和脑萎缩减少。
双刃剑
更多证据表明,小胶质细胞是导致疾病后期认知能力下降的神经元损失的驱动因素,这些证据来自 2019 年的两项研究。给小鼠服用一种阻断关键蛋白集落刺激因子 1 的药物,这种蛋白是小胶质细胞生存所必需的,结果表明可以去除大脑中约 90% 的小胶质细胞。在 tau 蛋白小鼠模型中,接受该药物的小鼠表现出 tau 蛋白病理和神经退化显著减少,这表明小胶质细胞是 tau 蛋白依赖性神经退化所必需的。这些发现表明,TREM2 信号传导似乎会产生矛盾的影响——保护性或有害性——具体取决于疾病进展的阶段。
从这项研究来看,TREM2 信号传导在阿尔茨海默病的症状前阶段以及可能的早期症状阶段(淀粉样蛋白积累时)可能有助于减少淀粉样蛋白对附近轴突和突触造成的损害。它还阻止了 tau 蛋白穿过皮层的推进。然而,一旦 tau 蛋白病理明确确立,小胶质细胞可能会驱动突触丢失和神经元死亡。
假设小胶质细胞在 tau 蛋白小鼠模型中的破坏性作用在人类阿尔茨海默病中也成立——这仍然是一个很大的假设——靶向小胶质细胞可能是一种可行的治疗策略。在疾病的症状前和早期症状阶段,最好促进小胶质细胞的激活,尤其是在淀粉样蛋白斑块周围。相反,在 tau 蛋白病理的更晚期阶段,降低小胶质细胞反应可能会减缓神经退化,以及认知能力下降的速度。
或许,随着我们更多地了解小胶质细胞对淀粉样蛋白和 tau 蛋白病理反应的行为方式,可以为开发治疗这种毁灭性疾病的疗法确定新的靶点。一项人体临床试验目前正在测试 TREM2 激活是否可以减缓早期阿尔茨海默病的进程,并且多种其他靶向小胶质细胞的疗法正在进入药物开发渠道。如果这些方法被证明是成功的,那么阿尔茨海默在著名的尸检中第三个被忽视的发现——在更广为人知的斑块和缠结之后——可能会被证明在减轻对患者大脑的可怕影响方面发挥重要作用。

