拉泽尔·科隆(Razel Colón)从记事起就饱受疼痛折磨。疼痛撕裂他的颈部和背部,射穿他的腿部,蔓延到他的脚,常常让他痛苦地扭动,丧失行动能力。他偶尔会发作“急性胸痛”,呼吸会突然变得困难。“感觉像一头大象坐在我的胸口,疼痛紧绷,”科隆告诉我。去急诊室和医院是家常便饭。“如果我幸运的话,”他说,“我可以一个月不去。”
科隆来自新泽西州霍博肯市,年仅 19 岁,但导致这些症状的镰状细胞病一直是他不请自来的伴侣。但他现在讲述他的故事,是从一个已经一年半没有经历过那种痛苦的人的角度。他可以做以前想都不敢想的事情:打篮球、举重、在冷水中游泳。他的长期医生,哈肯萨克大学医疗中心的儿科血液肿瘤学家斯泰西·里夫金-泽嫩伯格(Stacey Rifkin-Zenenberg)说,他的治疗“让他从患病者变成了携带者”。
科隆的案例代表了一项新兴技术曲线上的一个点,这项技术可能会永远改变我们治疗镰状细胞病等疾病的方法。基因组创新疗法的尖端世界再次处于爆炸性变革之中——而定制 DNA 正是这场对话的核心。
关于支持科学新闻报道
如果您喜欢这篇文章,请考虑通过以下方式支持我们屡获殊荣的新闻报道 订阅。通过购买订阅,您将帮助确保有关塑造我们当今世界的发现和想法的具有影响力的故事的未来。
这是大胆的新领域。一些策略,如基因疗法,已经存在一段时间,包括基因改造细胞以产生治疗效果的能力——即将校正后的基因添加到基因组中,以尝试治疗疾病。传统上,病毒被用来将健康基因传递到细胞中,但过去十年见证了深刻的变革。多种基因疗法已被批准用于治疗多种疾病:鳞状细胞皮肤癌、一种罕见的遗传性失明、黑色素瘤、血液疾病等等。
正是这种类型的治疗,作为由Bluebird Bio领导的最大的慢病毒持续基因治疗试验的一部分,有效地阻止了科隆的镰状细胞病病情。来自 19 名参与者的未发表的中期数据显示,这些参与者至少随访了六个月,并且有严重的血管闭塞事件 (VOE) 或类似于科隆的镰状细胞危象病史,所有患者的严重 VOE 均完全缓解,公司发言人表示。该试验仍在进行中,数据尚未完成,因此谨慎是明智的,但“前景非常广阔”,发言人说。
下一代技术,基因编辑,又上了一个层次。基因编辑使科学家能够精确地靶向许多生物(细菌、植物、动物)的异常基因,剪断 DNA,然后在切口部位去除、替换或添加新的 DNA。“想象一下,你有一辆汽车轮胎瘪了,”加州大学伯克利分校和创新基因组学研究所的基因编辑专家费奥多尔·乌尔诺夫(Fyodor Urnov)说。“基因疗法是拿一个备用轮胎,把它放在汽车的某个地方,希望它能跑起来。基因编辑是修理瘪了的轮胎。”
随着2012 年一种名为 CRISPR 的基因编辑工具的问世,这项技术获得了巨大的推动,CRISPR 是 Clustered Regularly Interspaced Short Palindromic Repeats(规律间隔性短回文重复序列簇)的缩写。CRISPR 技术比旧的基因组编辑方法更易于使用、更便宜、更高效,使科学家能够快速改变 DNA 序列以修饰基因功能。这可能对生物体的健康产生积极影响,甚至逆转疾病症状。
“它通常被描述为‘分子剪刀’,”其共同发明者、诺贝尔化学奖得主詹妮弗·杜德纳(Jennifer Doudna)说。“科学家可以利用 CRISPR 不仅切割任何生物 DNA 中的特定位置,还可以提供模板来修复 DNA。”
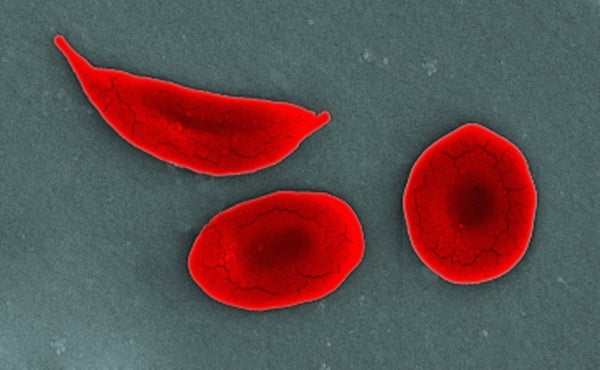
在镰状细胞病(SCD)中,β-血红蛋白基因中的单个突变导致红细胞变成新月形或镰刀形。这些镰刀状细胞具有粘性,它们会堵塞动脉,阻止足够的氧气输送到身体组织。这可能导致急性衰弱性疼痛发作,例如科隆经历的那种,并可能导致许多并发症:贫血、中风和累及肺、心脏、肾脏、脾脏等器官的损伤。
由于反复住院和输血,患者的生活质量通常很差,并且面临早逝的风险。在非洲和中东等医疗资源非常有限的地区,许多儿童在五岁之前死于 SCD。
CRISPR 正在加速通过基因工程治疗此类疾病的步伐。基因编辑先驱、CRISPR Therapeutics 创始人、斯坦福大学医学院儿科学教授马修·波特斯(Matthew Porteus)说,研究人员目前采用两种主要的基因编辑策略来尝试治愈镰状细胞病患者。一种类型使用 CRISPR 来从根本上翻转基因组开关,再次开启健康的胎儿血红蛋白的生产,这种血红蛋白在生命早期被关闭。优势是什么?胎儿血红蛋白不会镰刀化。
第二种基因编辑策略,基因校正,直接修复导致疾病的缺陷基因中的突变。就镰状细胞而言,校正使身体能够简单地产生正常的血红蛋白。研究人员已经记录了大量的工作,试图达到这一点。
虽然在批准了几种新药来帮助缓解 SCD 症状方面取得了进展,但它们并非治愈性的。骨髓(干细胞)移植是唯一的治愈选择,但找到健康的供体匹配可能具有挑战性。基因组疗法应运而生,加州大学圣地亚哥分校的西奥多·弗里德曼(Theodore Friedmann)于 1972 年首次提出用于治疗遗传疾病,同年,斯坦福大学的保罗·伯格(Paul Berg)生产重组 DNA,使基因组疗法朝着现实迈进了一步。在 20 世纪 80 年代,科学家们展示了如何将 DNA传递到细胞中,到 2003 年,整个人类基因组已被破译。
也曾出现过挫折,即使当基因编辑系统在新世纪开始时出现,使用它们仍然具有挑战性和耗时。然后,CRISPR出现了,它以切片和切块的方式进入临床领域,有望潜在地改变的不仅是治疗,还有疾病的预防。科学家们已经将这项技术用于研究癌症、淋巴瘤、艾滋病、囊性纤维化等疾病,用于包括SARS-CoV-2 检测在内的诊断,甚至在农业工作中用于培育更大的西红柿、不易褐变的苹果和保质期更长的蘑菇。
实时看来,希望基因编辑将为一种非常常见且使人衰弱的遗传病——镰状细胞病提供治愈方法。与我交谈的几位专家首次表示,SCD 的治愈方法可能即将出现。
这是一个令人震惊的想法。在实践中,切除无法工作的基因并用正常工作的基因替换它们的能力可能有助于减轻多种疾病的最坏影响。当 2020 年诺贝尔化学奖授予詹妮弗·杜德纳和埃玛纽埃尔·卡彭蒂耶(Emmanuelle Charpentier),以表彰她们发明这项技术时,瑞典皇家科学院秘书长戈兰·K·汉松(Goran K. Hansson)直言不讳地说:“今年的奖项是关于重写生命代码。”
科学家们已经在研究更精确的下一代 CRISPR 技术。“碱基编辑器”最近被证明可以治疗小鼠的镰状细胞病,它可以在不切割 DNA 双螺旋的情况下校正单字母 DNA 突变。还有“先导编辑器”,它可以替换更大的 DNA 错误。
这一切都非常了不起——而且还处于早期阶段。“血红蛋白病基因组疗法领域并非零和博弈,”乌尔诺夫说。“我确信最终会有多种获批药物。会有多种基因疗法获得批准,也会有多种基因编辑获得批准。”
仍然有许多问题需要考虑,包括基因编辑等概念可能发展到何种程度的道德影响,以及成本、安全性和可及性(专家表示,目前的治疗费用可能高达 200 万美元)。杜德纳说:“真正的治愈意味着为每个需要它的人提供治疗,这就是为什么我们正在努力开发下一代疗法,以降低成本并使其更易于获得。”而且,由于基因编辑并非完美,“所有基因修饰疗法的长期安全性都必须仔细研究,”波特斯说。
在未来几个月,加州大学联盟(加州大学旧金山分校、加州大学伯克利分校和加州大学洛杉矶分校)将进行首次人体开放标签 I-II 期试验,使用在创新基因组学研究所开发的非病毒传递 CRISPR 技术。科学家们希望通过用校正后的基因替代镰状细胞病试验参与者有缺陷的 β-珠蛋白基因(导致该疾病的基因),直接修复他们血液干细胞中的突变,从而减轻他们的痛苦。
“纠正并在健康红细胞中繁殖的突变越多,治愈的可能性就越大,”该试验的首席研究员、加州大学旧金山分校儿科教授马克·沃尔特斯(Mark Walters)说。“镰状细胞病将通过基因组疗法治愈。”毕竟,这是该技术的最高用途——即使在我们继续了解该领域的同时,它也可能成为现实。
这是一篇观点和分析文章;作者表达的观点不一定代表大众科学的观点。