1月10日,当中国研究人员公布一种神秘的、快速传播的病毒的基因组时,这证实了丹·巴鲁克最担心的事。该基因组与导致 2003 年 SARS 爆发的冠状病毒的基因组相似,但也存在显著差异。“我立刻意识到,没有人会对它免疫,”波士顿贝斯以色列女执事医疗中心病毒学和疫苗研究主任巴鲁克说。
几天之内,他的实验室和全球其他数十个实验室开始设计疫苗,他们希望这些疫苗能够保护数十亿人免受 SARS-CoV-2 病毒的侵害,这是自第二次世界大战以来对全球健康和繁荣的最大挑战。到 4 月初,19 个国家的近 80 家公司和研究所正在研发疫苗,其中大多数是基于基因的疫苗,而不是使用传统方法,例如 70 多年来用于流感疫苗的方法。实验室预测,到 2021 年初,商业疫苗可能会用于紧急或同情用药——考虑到针对全新病原体的疫苗需要十年才能完善和部署,这速度快得令人难以置信。即使是快速通道的埃博拉疫苗,也花了五年时间才进入广泛试验阶段。如果巴鲁克和他的同行们能在一年内提供一种安全有效的混合物,“这将是历史上最快的疫苗开发,”他说。
然而,这是一个很大的“如果”。尽管实验室已经为其他病毒研制了几种基于基因的疫苗,但没有一种已商业化用于人类疾病。
支持科学新闻事业
如果您喜欢这篇文章,请考虑通过以下方式支持我们屡获殊荣的新闻事业: 订阅。通过购买订阅,您将有助于确保未来能够继续报道关于发现和塑造我们当今世界的想法的具有影响力的故事。
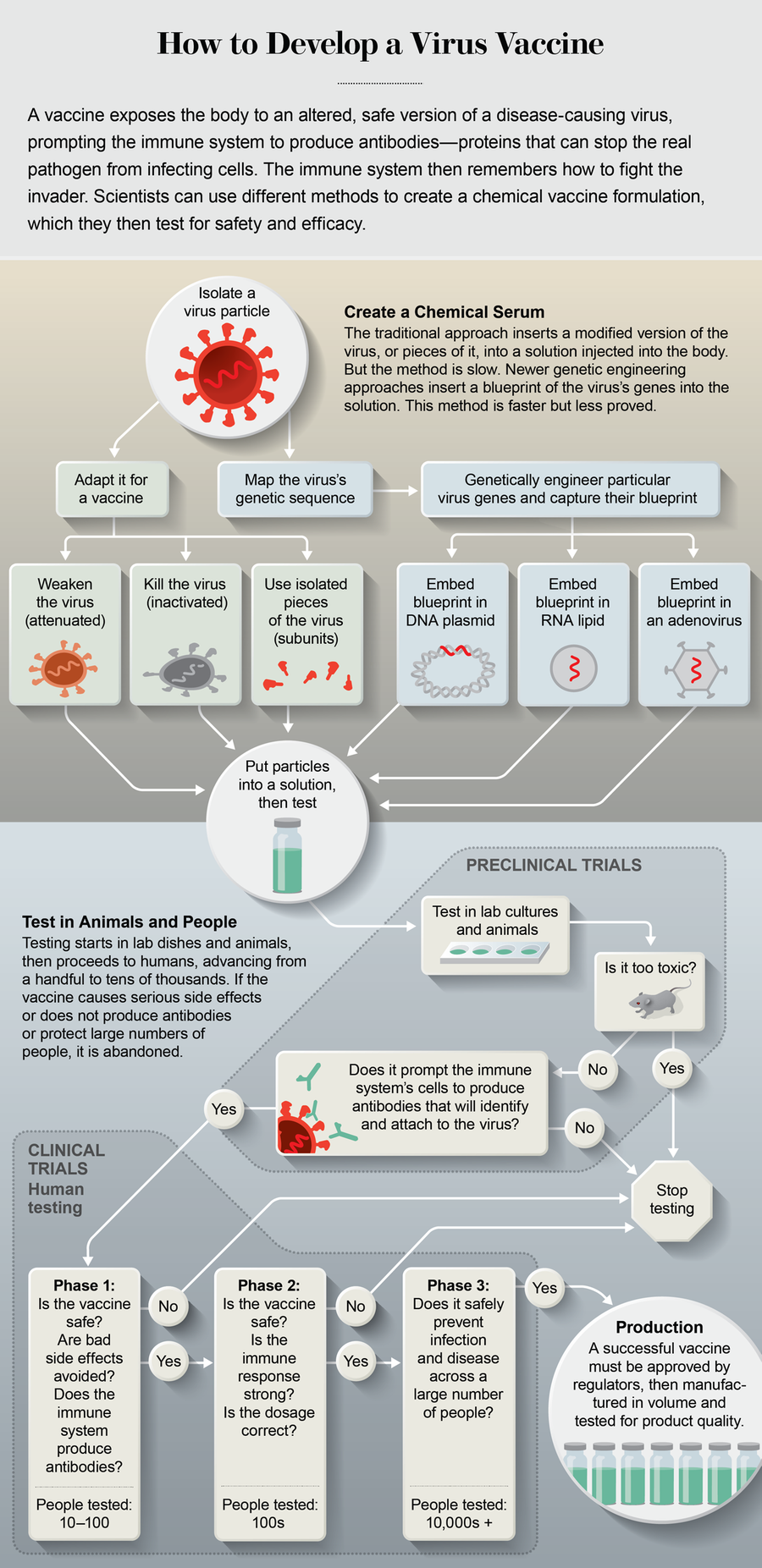
传统疫苗通过注射进入人体,将病毒的特定片段插入注射部位附近的细胞中。免疫系统将这些片段上的分子(称为抗原)识别为威胁,并通过产生抗体来做出反应,抗体是可以在体内任何地方找到病毒并中和它的分子。一旦发生这种演练,免疫系统就会记住如何消灭入侵者,从而阻止未来的感染。
既定方法是在鸡蛋中(或最近在哺乳动物或昆虫细胞中)培养减毒病毒,并提取所需的片段。对于每年都会变化的常见病毒(如流感),获得合适的抗原可能需要四到六个月的时间。对于一种新的病原体,可能需要多年多次尝试。对于已经蔓延到大流行程度的病毒来说,这太慢了。
相反,实验室正在转向基于基因的疫苗。科学家们利用病毒基因组的信息来创建选择性抗原的蓝图。该蓝图由 DNA 或 RNA 构成——这些分子携带遗传指令。然后,研究人员将 DNA 或 RNA 注射到人体细胞中。细胞的机制使用这些指令来制造病毒抗原,免疫系统会对这些抗原做出反应。细胞对指令的反应是其日常存在的一部分。这与传染性病毒利用的特性相同;它们无法自行繁殖,因此它们利用细胞的机制来复制自身。它们从细胞中爆裂出来并感染更多细胞,扩大感染范围。
图片来源:Jen Christiansen
几乎所有实验室都希望找到一种方法来训练人体细胞产生一种名为刺突蛋白的抗原。它像轮胎上的螺柱一样从 SARS-CoV-2 中突出,使病毒能够与人体细胞结合并潜入内部。几乎所有实验室都使用三种方法之一来传递刺突蓝图。第一种是 DNA 质粒,通常是一个小的环状分子。质粒是一种方便的工具,因为如果病毒发生变异,研究人员可以很容易地换入新的蓝图。DNA 质粒疫苗已用于鱼类、狗、猪和马的兽医用途,但人类应用一直滞后,主要是因为疫苗难以穿过细胞的保护性外膜到达内部机制。最近的一项改进是用一种仪器注射疫苗,该仪器对注射部位附近的细胞施加短暂的电荷,从而在细胞膜上打开孔隙,使疫苗能够进入。
Inovio Pharmaceuticals 公司总部位于宾夕法尼亚州普利茅斯会议,正在采用 DNA 质粒方法。几年前,该公司启动了针对另一种冠状病毒疾病——中东呼吸综合征 (MERS) 的刺突蛋白的临床试验。据首席执行官 Joseph Kim 称,疫苗接种者体内的抗体水平“与我们在从 [自然] 康复的 MERS 患者的血液样本中看到的抗体水平一样好或更好”。该公司调整了其平台——质粒及其测试方法——以制造 SARS-CoV-2 疫苗。
DNA 质粒疫苗的工作原理是将遗传蓝图转移到细胞机制中的 RNA,从而产生刺突抗原。但科学家们可以通过将蓝图嵌入 RNA 链中来跳过质粒步骤——第二种方法称为 RNA 疫苗。RNA 携带在脂质中,脂质被注射到体内;脂质是脂肪分子,可以很容易地进入细胞。研究表明,RNA 疫苗可能比 DNA 质粒在动员免疫系统产生抗体方面更好。它们似乎还能诱导更强大的免疫力——免疫系统中更强的记忆力——因此需要更低的剂量。一些 RNA 疫苗正处于其他病毒性疾病(包括狂犬病、HIV 和寨卡病毒)的早期临床试验阶段。位于马萨诸塞州剑桥市的 Moderna 公司正在将这种方法用于 SARS-CoV-2。
RNA 疫苗不如 DNA 质粒疫苗稳定;体内常见的酶可以快速降解它们。热量也会破坏它们。RNA 疫苗通常必须冷冻或冷藏保存,这会造成后勤障碍,尤其是在较贫穷的国家。DNA 质粒疫苗在较高温度下是稳定的。
巴鲁克和他在强生公司的合作者正在使用第三种方法:将 DNA 蓝图插入普通感冒病毒中。当注射时,这种所谓的腺病毒载体感染人体细胞并传递它所携带的蓝图。腺病毒擅长进入细胞,但过去的研究表明,人体免疫系统很容易识别某些腺病毒并在它们潜入之前攻击它们。巴鲁克正在使用一种经测试表明不太可能被识别的腺病毒。一些专家还担心腺病毒本身可能会在体内复制并引起疾病。为了解决这种可能性,巴鲁克的团队正在使用一种工程病毒,该病毒是非复制性的——它无法在人体细胞内复制自身,因为它需要一种人体不提供的复制物质。4 月下旬,牛津大学开始对另一种非复制性腺病毒进行有限的人体试验。
一旦疫苗的基本功能在实验室培养中得到证实,就会在动物身上进行评估,以查看其是否安全以及是否能引起免疫反应。接下来,它会在人体中进行测试——首先是小群体,以检查安全性和副作用,然后是越来越多的群体,以查看其有效性。Inovio 的 DNA 质粒于 4 月 6 日进入小规模人体试验——仅在 SARS-CoV-2 基因组发布三个月后。Moderna 更早地于 3 月 16 日开始了其 RNA 疫苗的小型人体试验,4 月,美国政府承诺提供高达 4.83 亿美元的资金,以加快大规模生产(如果试验进展顺利)。巴鲁克的实验室在短短四周内设计出了一种原型腺病毒疫苗。强生公司与巴鲁克的实验室合作,目前正在小鼠、雪貂和恒河猴身上进行测试。3 月 30 日,美国和强生公司承诺投入超过 10 亿美元,为大型人体临床试验提供资金,如果有限的测试证明有效,这些试验计划于 9 月开始。
尽管从疫情爆发到小型测试的时间比使用鸡蛋方法要快得多,但不能保证基因工程疫苗的扩展试验不会花费数年时间。幸运的是,SARS-CoV-2 的变异速度似乎不如流感那么快,这表明一旦开发出有效的疫苗,可能会提供长期的保护。
除了有效性之外,专家们还在关注试验中是否会出现“疾病增强”——疫苗可能会意外加重 COVID-19 症状的可能性,COVID-19 是 SARS-CoV-2 引起的疾病。2004 年,接受实验性 SARS 疫苗的雪貂出现了破坏性炎症。Kim 说,接受实验性 SARS 疫苗治疗的人类没有出现疾病增强。但这些配方从未进入大规模人体试验,因为疫情——在近 30 个国家感染了约 8,000 人——在一年多一点的时间内就消退了。
公司正在加快 SARS-CoV-2 疫苗的开发时间,部分原因是同时在多种动物物种中测试疫苗,并与少量人群并行进行。通常,该过程是一次一种动物,然后是人,以确保副作用小、免疫反应大以及疾病实际上被击败。时间紧迫值得冒更大的风险。
保护全球免受 COVID-19 侵害将需要巨大的生产能力。DNA 质粒疫苗和 RNA 疫苗从未扩大到数百万剂的规模,Inovio 和 Moderna 等小型公司也不会在内部拥有这种能力。根据巴鲁克的说法,腺病毒疫苗在开始时更耗时,但一旦被证明有效,“可以快速扩大规模”。强生公司使用腺病毒方法生产了数百万剂埃博拉疫苗,目前该疫苗已在广泛的人体试验中。一些小组正在研究其他可能需要更长时间的 DNA 技术。
亚利桑那州立大学的病毒学家和冠状病毒专家 Brenda G. Hogue 表示,目前还没有明显的首选原型疫苗。但她说,基因研究的速度以及公司全力投入的力度令人鼓舞:“我感到非常乐观。”
阅读更多关于冠状病毒爆发的信息 请点击此处访问《大众科学》。并阅读我们 国际杂志网络的报道,请点击此处。