汉娜·科德曼正试图填补她世界中的空白,但空白正在变得越来越大。她无法总是听到对话,所以她会在看似适当的时刻点头或微笑,从周围的人那里获取线索。即使医生最近调大了她的助听器音量,辨别单个词语仍然很困难。“对话中遗漏了很多东西——零零碎碎,”她说。“但我会设法应付。”
应付变得越来越困难。科德曼患有一种名为 Usher 综合征的遗传性疾病,这种疾病正在缓慢但不可阻挡地剥夺她的两种主要感官。一种基因突变正在使她内耳和视网膜中的细胞缺乏检测声音和光线所需的蛋白质。除了听力丧失外,她的视力也在下降,这迫使她十几岁时就放弃了夜间驾驶,最近情况变得更糟。现在,24 岁的她出现了盲点,使得白天看东西也更加困难。目前尚无治疗方法可以阻止或减缓这种疾病,因此科德曼知道,在 10 年后,如果恶化缓慢,也许是 20 年后,她可能会失聪失明。
小时候,科德曼的问题似乎只是单纯的听力障碍。然后在高中时的一个夏天,当她从马萨诸塞州尼德姆的家中抬头望向天空时,星星似乎一颗一颗地消失了。她告诉自己,它们可能只是被云层遮住了。但问题仍在继续,最终医生诊断她患有 Usher 2A 型,这是一种聋盲障碍,会在多年内逐渐发作。当我和她谈话时,她告诉我,她平静地接受了这个消息。她说,在消化了消息后,她决定继续自己的生活。今天,在她被诊断出患病七年后,科德曼已经大学毕业,并在她家的建筑公司从事营销工作,尽可能地对抗这种她认为不会定义她的疾病。
支持科学新闻报道
如果您喜欢这篇文章,请考虑通过以下方式支持我们屡获殊荣的新闻报道 订阅。通过购买订阅,您将帮助确保有关塑造我们当今世界的发现和想法的具有影响力的故事的未来。
医生对此束手无策。科德曼将来有一天可能会接受人工耳蜗植入,这是一种绕过毛细胞直接刺激听觉神经并给她一些声音感觉的装置。但这种装置是一种相对粗糙的解决方案。对于眼睛,视网膜植入物——用于光敏细胞的电刺激器——很少使用,因为它们远未达到实际视觉的效果。
科德曼不是科学期刊的忠实读者,但她知道在波士顿的几个实验室里有数百只幼鼠,离她家不远。这些小鼠被培育出患有像她一样的听觉障碍——但这些小鼠正在好转。生物学家们使用一种称为基因疗法的方法,给它们注射健康的 DNA,以弥补产生缺陷蛋白质的错误片段。2017 年,波士顿儿童医院的生物学家格温纳埃尔·盖莱奥克和她的同事报告说,在科学家向小鼠内耳输送 DNA 后,这些小鼠的听力恢复到接近正常水平,取得了“前所未有的恢复”。大约在同一时间,哈佛医学院的一个独立团队报告说,当他们对患有不同遗传性疾病的小鼠使用类似的基因方法时,听力恢复程度较为温和。波士顿地区的第三个研究小组最近采用了基因编辑方法,敲除了“贝多芬小鼠”中的一个缺陷基因——这种啮齿动物患有另一种以这位失聪作曲家命名的进行性听力下降疾病。这些进展为首次治疗遗传性听力障碍——美国最常见的出生缺陷之一——甚至从源头上阻止它们带来了希望。
病毒式传播
基因疗法有着艰难而曲折的过去。在 1999 年一起臭名昭著的事件中,一名 18 岁的肝病患者杰西·盖尔辛格在宾夕法尼亚大学研究人员进行的一项早期基因疗法试验中死亡。病毒被用来将基因运送到他的体内,但剂量和类型导致盖尔辛格的免疫系统陷入致命的狂乱,攻击他自己的器官。这场悲剧使公众的热情和资金降温,并使许多科学家对进一步发展持谨慎态度。

汉娜·科德曼天生患有 Usher 综合征,这是一种遗传性疾病,正在逐渐剥夺她的听力和视力。图片来源:伊桑·希尔
然而,其他人继续默默地研究这项技术,最初专注于细胞和动物,希望开发出治疗骨关节炎、癌症和 1 型糖尿病等复杂疾病的方法。作为一种安全措施,他们降低了用作递送载体的病毒剂量,以防止免疫系统过度反应。他们还放弃了曾用于盖尔辛格身上的病毒——腺病毒组的一种成员,转而试验其他类型。一种有希望的替代方案在这些测试中表现得特别好:腺相关病毒 (AAV),一种基因信使,它对人类免疫系统似乎是良性的,因为它不会损害我们的细胞。有时,携带基因的病毒在注射时会被预先包装在细胞内,这种技术可以使它们保持在一个小的目标区域。美国国立卫生研究院的研究员辛西娅·E·邓巴说,这个领域已经变成了“为正确的疾病和靶点匹配正确的载体,并了解剂量以及病毒在体内的去向”,她最近担任美国基因与细胞治疗学会主席。
这些改进已经奏效。美国食品药品监督管理局 (FDA) 现在已经发布了第一批人类基因疗法批准,表明这可能是一个时机终于成熟的想法。2017 年 8 月,FDA 为 Kymriah 开了绿灯,这是一种病毒递送的儿童白血病治疗方法。在同年 12 月,该机构批准了首个用于治疗一种罕见遗传性失明的基因疗法。邓巴说,制药公司和风险投资家现在正在向基因疗法投入大量资源。在该学会 2018 年的年会上,约有 3400 人出席。而五年前,只有 1200 人参加。
图片来源:艾米丽·库珀
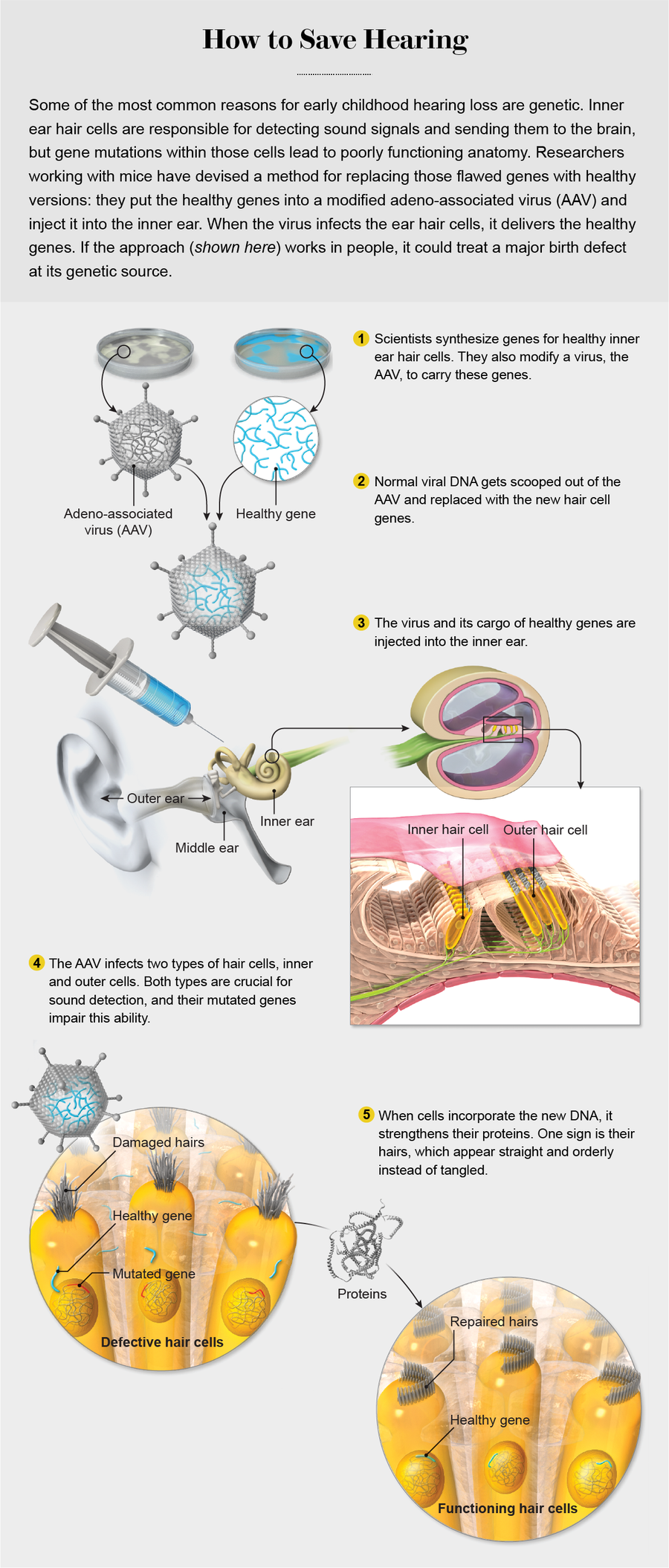
这种热情现在也扩展到了听力损失,这是一种通常与遗传有关的疾病。虽然听力损失通常与衰老或事故有关,但它是最常见的出生缺陷之一;每 1000 名婴儿中就有多达 3 名患有听力损失。遗传缺陷是其中一半以上病例的原因,包括 Usher 综合征等疾病。Usher 是一种特别有吸引力的靶点,因为每位患者都有单个基因突变,修复这些突变就可以修复症状。某些形式的疾病,如科德曼的疾病,会逐渐发展,这为诊断后治疗提供了窗口期,可以在此期间阻止基因引发的损害。这种损害发生在内耳的毛细胞中——毛细胞接收来自外部的声波,并将它们传递到大脑。科德曼和其他像她一样的人有缺陷的基因,导致毛细胞生长虚弱。哈佛大学科学家大卫·科里说,这些细胞“就像汽车里的火花塞”。科里是恢复某些小鼠听觉感觉的科学家之一。“没有它们,听力就无法工作。”
针对这些细胞的基因疗法是一种治疗疾病根源的方法,而不是使用助听器等高科技创可贴。加州大学圣地亚哥分校基因疗法研究人员联合会的负责人之一、儿科医生西奥多·弗里德曼说,最近的“成功是非常令人印象深刻和重要的早期有希望的步骤”,他没有参与这项工作。当然,小鼠不是人,这种技术尚未在人体上进行试验。但弗里德曼说,这些干预措施确实有史以来第一次为在基因水平上治疗耳聋打开了大门。
毛细胞治疗
2017 年的一天早上,在哈佛大学的一个实验室里,我看到本斯·吉尔吉探身穿过那扇门。他实际上是在弯腰观察一只被培育出患有缺陷毛细胞基因的啮齿动物。这只小鼠已被麻醉,吉尔吉是科里的博士后研究员,他在动物的耳朵后面做了一个微小的切口。当他寻找中耳中称为圆窗膜的部位(通往内耳的门户)时,他推开了薄如蝉翼的组织碎片。当吉尔吉找到圆窗膜时,他插入了一根细针,开始缓慢注射一种淡粉色溶液,其中含有约 2000 亿个 AAV 颗粒,每个颗粒都携带一种经过校正的基因形式,该基因负责小鼠的听力损失。
使用像 AAV 这样的病毒来运送珍贵的货物,增加了基因到达内耳目的地的机会,因为即使是无害的病毒也擅长感染细胞。然而,研究人员已经了解到,他们不能使用任何 AAV。成功的 AAV 的标志是不仅能够感染一种毛细胞,而且能够感染两种毛细胞。各种 AAV 在将 DNA 递送到最内排的毛细胞(与神经细胞通信)方面相当出色,但这些相同的病毒在进入外排的毛细胞方面做得不好,而外排的毛细胞才是首先放大声音的细胞。科里说,为了完全恢复敏感性,载体需要进入两种类型的细胞,科里对毛细胞功能进行了一些关键研究。

通过使用病毒将健康基因运送到失聪小鼠体内,波士顿儿童医院的研究人员格温纳埃尔·盖莱奥克和杰弗里·霍尔特恢复了啮齿动物的听觉。图片来源:伊桑·希尔
通过反复试验和一些病毒基因的重新设计,科学家们偶然发现了一些 AAV,它们强烈地被内耳的两个靶点所吸引。他们改变了构成病毒外壳的蛋白质,这些分子有助于病毒与细胞靶点结合。最终,这项工作产生了一组外壳蛋白,这些蛋白似乎与两种类型毛细胞上的分子相匹配,使病毒能够进入细胞内部。在盖莱奥克及其同事于 2017 年发表的论文中,研究人员报告说,其中一种经过特殊修饰的 AAV 完整地到达了天生注定失聪的啮齿动物体内,并产生了排列整齐、功能良好的毛细胞。其他研究小组报告说,他们能够将相关的 AAV 送入年龄较大的啮齿动物的内耳毛细胞,这些啮齿动物的耳朵更像幼儿的耳朵。
然而,进入只是听力治疗问题的一部分。另一部分是识别导致毛细胞缺陷的突变。研究人员在 20 世纪 90 年代开始这样做,他们通过识别具有 Usher 典型听力和视力丧失的家庭,并比较他们的基因组。这些人有几个似乎与耳朵和眼睛发育有关的基因,这使得它们成为主要嫌疑对象。然后,科学家们培育出带有和不带有这些疑似突变的小鼠,以测试任何基因变化是否真的导致了症状。比较结果指向了一些特定的改变。例如,USH2A 基因的改变是科德曼等人的渐进性疾病的幕后原因;该基因的非突变版本产生健康的毛细胞。最严重和快速发病形式的疾病(称为 Usher 1 型)的每种病例都与五种不同基因之一(如称为 USH1C 的基因)的突变有关。
在过去的几年里,盖莱奥克的团队将所有这些碎片拼凑在一起。在实验室里,她和她的丈夫、耳鼻喉科医生杰弗里·霍尔特以及其他人使用了一种带有定制外壳的 AAV 版本,挖出了一堆与其病毒生命周期相关的基因,并用完整、健康的 USH1C 版本取代了它们。他们还添加了一个称为启动子的 DNA 序列,该序列在毛细胞中开启 USH1C。当新基因被递送到细胞中时,它就像细胞的助推器。细胞仍然具有产生虚弱毛细胞蛋白的旧的、缺陷的 DNA,但添加功能良好的 DNA 有助于它们产生大量其他健康的蛋白质,从而保持毛细胞的强壮。
然后,波士顿儿童医院的团队将整个包裹取出,并使用类似于我在吉尔吉使用的手术插入方法,将其放入 Usher 小鼠体内。两周内,病毒至少感染了一些耳毛细胞;到六周时,它已渗透到约 80% 的耳毛细胞。更重要的是,这些动物对声音做出了反应。恢复耳功能的主要测试之一包括让啮齿动物暴露于突然的、令人吃惊的噪音中,以观察它们是否会跳跃。许多啮齿动物都跳跃了:曾经失聪的小鼠可以听到了。
声音不是唯一重要的检查。毛细胞在体内还有另一项关键工作:当毛细胞在内耳液体中弯曲时,它们会产生平衡感和方向感,将有关其位置的信号发送到大脑。毛细胞因 Usher 综合征受损的小鼠通常在运动和确定自己在空间中的位置方面存在困难。这些啮齿动物不会在笼子里到处嗅探,而是蜷缩在角落里。虽然小鼠是天生的游泳健将——第一次被放入水中时就准备好茁壮成长——但 Usher 小鼠会在水中疯狂地转圈划水几秒钟,努力确定哪一边是“向上”的。(科学家会在动物过于痛苦之前迅速将其救出。)如果波士顿儿童医院的基因疗法小鼠真的恢复了毛细胞功能,那么这些问题应该已经消失了。
在我访问哈佛大学实验室后不久,当我参观霍尔特和盖莱奥克的实验室时,我看到的小鼠表现得非常像,嗯,小鼠。两个月前接受基因治疗的啮齿动物在它们的环境中四处嗅探;它们在开放空间和水中的行为与正常的同类几乎没有区别。它们移动得如此轻松,以至于我多次询问霍尔特和他的团队,他们是否确定这些是带有突变的小鼠。科学家们有一个仔细的系统来跟踪他们的动物,他们每次都向我保证,我看到的是受损和经过治疗的啮齿动物。
问题的大小
尽管取得了这一成功,但在这些病毒用于人体之前,仍有几个令人烦恼的难题需要解决。一个问题是目前的 AAV 太小了。虽然它们足够大,可以携带基因来纠正 Usher 1C 型——这种疾病在小鼠试验中反应良好——但许多其他类型涉及更大的基因。例如,科德曼的 Usher 类型涉及的基因就太大了,无法塞进可用的 AAV 存储空间。“这就像试图将 14 码的身体塞进 4 码的裤子里,”邓巴说。
一种解决办法是将大型基因切成几块,这些基因块可以通过多个病毒载体运送到耳朵中。每个基因片段都会有粘性末端,这样当它们到达目的地时,它们就可以像尼龙搭扣一样粘在一起。例如,科德曼类型的 Usher 基因非常大,需要切成三部分。为了使这种方法奏效,所有三个病毒载体都必须进入内耳毛细胞,然后这三段 DNA 需要在一个细胞内找到彼此并将它们粘在一起。DNA 序列的高度特异性使这成为可能——通常在体内,遗传字母的片段仅与互补片段相互作用——但这仍然难以实现,盖莱奥克说。
其他选择包括使用更大的非 AAV 病毒,经过调整以避免广泛的免疫系统警报,或者完全避免使用病毒,并尝试在纳米颗粒(可以穿透细胞的微小实验室制造物体)内递送遗传物质。包括霍尔特和盖莱奥克在内的多位研究人员也在探索一种使用基因编辑技术 CRISPR-Cas9 来移除问题基因并用正确的基因替换它的方法。Usher 是一种隐性疾病,由两个拷贝的缺陷基因引起。如果研究人员可以切除其中一个基因并换入一个健康的显性基因,那么这个新基因就可以接管并抵消剩余隐性 DNA 的负面影响。
然而,尚无人使用 CRISPR 实现这一壮举;这种方法似乎更适合切除东西,而不是粘贴东西。因此,目前在小鼠身上进行的 CRISPR 工作似乎更适合由一个缺陷基因而不是两个缺陷基因引起的罕见听力问题。问题基因可以简单地被敲除,让剩余的基因正常工作。贝多芬小鼠的实验就使用了这种方法。虽然效果良好,但其他使用 CRISPR 的科学家已经看到,它在其他非靶向细胞上引起了不必要的 DNA 变化。因此,没有人认为这种类型的基因编辑已准备好用于人类。病毒载体似乎仍然是治疗的前沿。
无论研究人员设计出何种递送系统或其他解决方案,除非婴儿的听力损失诊断得到改善,否则它将无法帮助很多人,而婴儿将从早期干预中获益最多。在美国,大多数新生儿都接受听力损失筛查,但他们很少被诊断出患有特定疾病或其潜在的遗传原因。科德曼的情况正是如此,她在高中时才被诊断出患有遗传问题。这种情况需要改变,以便儿童能够得到适当的治疗。
基因治疗师确实认为他们将能够治疗儿童——而且可能很快就能实现。“令人兴奋的是,实际产品正在通过系统逐步实现,”邓巴说。贝勒医学院的基因治疗研究员伊丽莎白·奥尔姆斯特德-戴维斯说,她对其他疾病的基因疗法最近成为临床现实以及新的治疗方法最终将遵循相同的道路并不感到惊讶。“地平线上的疗法是才华横溢的研究人员数十年工作的结晶,他们看到了这些方法所蕴含的潜力,”她说。
虽然研究界对基因疗法的兴趣显然正在激增,但汉娜·科德曼并没有等待这股浪潮到达她身边。无论医疗技术是否进步,她都决心过上充实的生活。她预订了多次观看北极光的旅行,以防有一天她再也看不见它们。“我想说我对生活的看法已经完全改变了,因为感觉我只有这么多时间来完成事情,”她说。她也成为了其他患者的倡导者。科德曼说,她意识到公开谈论遗传问题可以帮助推动研究进一步发展,并且“有可能激励其他人活出自己的生活,不要让这种疾病阻碍他们”。她说,失去听力并不意味着退缩到沉默中。

