保护主义者和生物伦理学家通常以惊奇、兴奋和恐惧的复杂心情看待被称为“基因驱动”的工程 DNA 包裹。基因驱动违反了正常的遗传规则,确保它们传递给宿主生物体的所有后代,而不仅仅是一半;因此,它们具有令人不安的潜力,可以快速且不可撤销地改变种群。关于基因驱动的大部分争议都集中在使用它们来控制危险昆虫害虫的实用性(和狂妄自大),因为昆虫几乎是唯一被证明基因驱动有效的动物。
现在情况已经改变。在今天发表在自然杂志上的一篇论文中,加州大学圣地亚哥分校的生物学家首次证明,当前的基因驱动技术在哺乳动物(小鼠)身上也有效——至少在一定程度上是有效的。他们的发现突出了基因驱动在现实世界中应用的潜力,但也指出了其显著的局限性。在未来相当长一段时间内,这些“主动遗传学”技术可能更适合作为实验室工具,而不是改造自然的工具。
关于支持科学新闻
如果您喜欢这篇文章,请考虑通过以下方式支持我们屡获殊荣的新闻报道: 订阅。通过购买订阅,您正在帮助确保有关塑造我们今天世界的发现和想法的具有影响力的故事的未来。
弗雷德·古尔德,北卡罗来纳州立大学的昆虫学家和进化生物学家,将基因驱动比作库尔特·冯内古特的小说《猫的摇篮》中的虚构物质冰-九:一种奇怪的冰的形式,可以冻结它接触的所有其他水。基因驱动传播迅速,因为它们是遗传元件的集合,这些元件可以自发地从母本染色体复制到匹配的父本染色体,反之亦然。在自我复制的过程中,基因驱动还可以在其插入点添加、删除或修改基因。早在 2003 年,基因驱动就被认为是一种理论上的可能性,但 2012 年 CRISPR/Cas9 基因组编辑技术的出现突然使其变得更加可行。
尽管法律限制、伦理担忧和对意外后果的恐惧阻碍了基因驱动在野外的测试,但它们可能带来的假设性好处的诱惑促使科学家继续研究它们。例如,一个受到良好监管的基因驱动可能通过使按蚊对疟疾寄生虫感染产生抗性,从而挽救数百万人的生命。
人们对开发基因驱动来控制大鼠和小鼠的兴趣也很高,因为作为入侵物种,它们经常严重威胁野生动物。在北太平洋重要的信天翁繁殖地中途岛,大约一个世纪前到达的掠食性老鼠几乎将这些鸟类消灭殆尽。1995 年进行的大规模毒杀运动消灭了老鼠,拯救了信天翁——但保护主义者宁愿有一种不那么粗暴的武器来阻止其他情况下的有害哺乳动物。(根据一年前的报道,中途岛上的小鼠现在正成为鸟类的新威胁。)
然而,最初吸引发育生物学家金伯利·库珀涉足小鼠基因驱动技术的并非保护,而是进化。在她位于 UCSD 的实验室中,她和她的同事研究跳鼠的进化,这是一种长腿啮齿动物,具有跳跃的双足步态,在数千万年前从小鼠谱系中分离出来。库珀和她的同事正试图通过让实验小鼠携带越来越多的跳鼠特征,来寻找导致这种进化转变的未知基因变化组合。
然而,对于哺乳动物来说,这种项目非常繁琐,因为通过传统的育种方式将所需的基因导入个体动物涉及到很多工作。遗传实验通常需要对于某种性状为纯合的动物,这意味着它们在母本和父本染色体上都携带相关基因的拷贝。为了创造一只对于仅仅三个感兴趣的突变为纯合子的小鼠,研究人员可能需要将数百甚至数千只具有单染色体突变的小鼠进行杂交。库珀的跳鼠项目很容易最终需要对于 10 个或更多基因为纯合子的小鼠。
“我一直认为这是不可能的,因为在小鼠中,将多种事物组合在一起的遗传学是一团糟,”她说。“你需要很多动物。这需要大量的时间和大量的金钱。”
但三年前,她受到 UCSD 同事 瓦伦蒂诺·甘茨 和 伊桑·比尔 的启发,开始效仿他们的做法。这两位生物学家最近证明了他们在果蝇身上称之为“主动遗传学”的技术。主动遗传学指的是使用遗传元件将特定性状的遗传率提高到超过格雷戈尔·孟德尔首次观察到的正常 50% 的比率;甘茨和比尔将基因驱动归类为一种自我永续的主动遗传学形式。
“我认识到相同的技术可以用于实验室,理想情况下可以提高工程改造基因版本的遗传率,”库珀说。它还可以让她引入来自小鼠以外物种的基因。“你可以制造出以前可能无法制造的基因复杂的动物。”
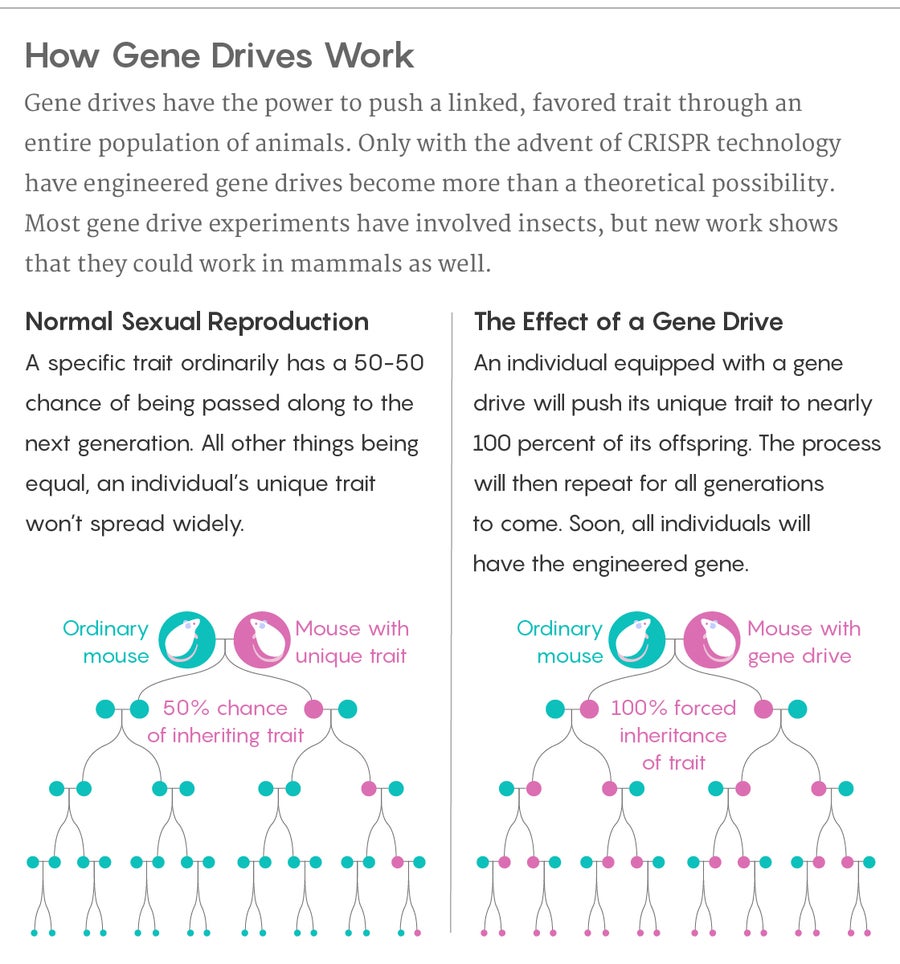
来源:露西·雷丁-伊坎达 量子杂志
正如他们在他们的新论文中描述的那样,库珀和她的团队设计了一种主动遗传学机制,使一个“标记”基因能够在小鼠谱系中快速传播。库珀强调,他们制造的在技术上不是基因驱动:作为一项安全措施,她的机制的两个组成部分——一个负责切割 DNA,另一个负责靶向切割——被分离到基因组的不同部分。这种分离阻止了该机制在多代中不受控制地传播。然而,它的成功证明了基因驱动在哺乳动物中的概念可行性。
即便如此,这种成功也伴随着一些限制。出乎意料的是,库珀的主动遗传学系统在雄性小鼠身上不起作用,只在雌性小鼠身上起作用。即使在雌性小鼠中,该机制也最多只有约 70% 的时间有效。
“如果现在有人试图使用这种类型的机制构建基因驱动,它不会非常迅速地在种群中传播,并且可能不会持久,”库珀说。对雌性的限制也会降低基因驱动开发新的实验动物品系的效率,但至少可以加快育种过程。
她和她的同事怀疑,基因复制机制在雄性和雌性中表现不同,是因为精子和卵子的产生方式存在细微差异。在卵子生成细胞中,染色体对可能在生产过程中更早地排列在一起,如果其中一条染色体被切割,细胞将使用来自其伙伴的所需 DNA 对其进行修复的可能性会更高。“如果我们能够掌握好时机,我们或许能够提高效率,并使其在雄性中也起作用,”库珀说。
安东尼·詹姆斯,加州大学欧文分校的分子遗传学家说,经过一些改进,主动遗传学最终应该能够用于生产不同领域遗传学研究所需的复杂实验动物,从而为今天的技术提供更有效的替代方案。(詹姆斯在 2015 年与甘茨和比尔合作开发了一种实验性的蚊子抗疟疾基因驱动。)他说,过去使用传统育种方法培育具有许多基因特定组合的小鼠可能需要十年时间;而主动遗传学可能会将时间缩短到一到两年。
使用 CRISPR 将基因逐个插入小鼠体内是另一种方法,但他认为主动遗传学也将优于这种方法。“普通旧式 CRISPR 非常适合修改已经存在的基因,”他说。“但是,如果你想添加基因,或者将它们换出并替换掉,基因驱动系统会更好。”
布鲁斯·康克林,旧金山格莱斯顿研究所的遗传学家,他为自然杂志撰写了一篇关于库珀研究的评论,他对主动遗传学表达的热情更为谨慎。“这很有价值,但借助 CRISPR,我们[已经]可以非常快速地构建非常复杂的模型,”他说。尽管如此,他赞扬这项工作突出了雄性和雌性细胞生物学中被忽视的差异,并且他认为它所倡导的主动遗传学方法可能有助于理解 DNA 修复和分子生物学中的其他基本机制。
库珀看到了基因驱动在哺乳动物中似乎比在昆虫中更难创造的光明一面,考虑到围绕其潜在用途的争议。提高主动遗传学在哺乳动物中的效率还需要几年时间。“与此同时,我们可以就[基因驱动]在野外可以而且应该做什么进行认真的对话,”她说。
经量子杂志许可转载,量子杂志是西蒙斯基金会的编辑独立出版物,其使命是通过报道数学以及物理和生命科学的研究进展和趋势来增进公众对科学的理解。
