CRISPR,这项革新了生物研究的基因编辑技术,终于在获得监管批准后成为一种医疗手段。12月8日,美国食品和药物管理局批准了首个CRISPR疗法,用于治疗镰状细胞病。
该疗法名为exa-cel,由Vertex和CRISPR Therapeutics公司生产,它编辑一个与红细胞形状和功能相关的基因。该疗法似乎在功能上治愈了该疾病至少一年。FDA的决定使美国成为继英国在11月批准exa-cel用于治疗镰状细胞病之后,第二个批准CRISPR疗法的国家。
范德堡大学血液学家迈克尔·德保恩表示,从科学角度来看,exa-cel是“一项令人难以置信的资产”。但他补充说,现在判断该疗法是否具有永久性且无副作用还为时过早。
关于支持科学新闻报道
如果您喜欢这篇文章,请考虑通过以下方式支持我们屡获殊荣的新闻报道 订阅。通过购买订阅,您将帮助确保未来能够继续报道有关塑造我们当今世界的发现和思想的具有影响力的故事。
FDA今天还批准了另一种用于治疗镰状细胞病的基因疗法,名为lovo-cel,由bluebird bio公司生产。
什么是镰状细胞病?新型CRISPR疗法是如何起作用的?
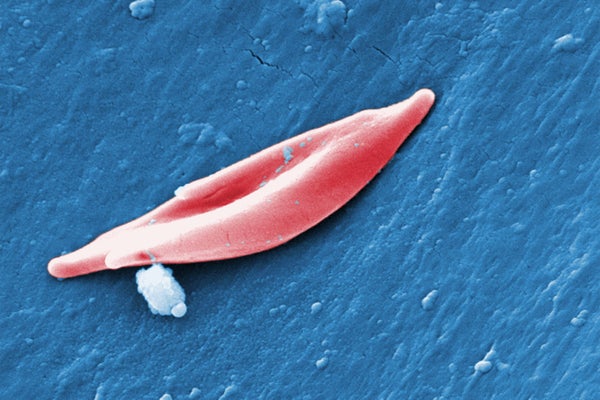
exa-cel中使用的CRISPR系统靶向产生血红蛋白的基因,血红蛋白是血液细胞中携带氧气的蛋白质。在一种称为镰状细胞贫血症的镰状细胞病中,HBB基因的突变会影响蛋白质的结构,导致其将通常为圆形的红细胞扭曲成弯曲的镰刀形状。这些镰状细胞会堵塞血管,导致剧烈疼痛和疲劳。在一种相关的疾病,即β-地中海贫血症(有时与镰状细胞贫血症同时发生)中,身体无法产生足够的血红蛋白或红细胞,导致低血氧水平引起的症状。这些症状包括疲劳和儿童生长问题。
Exa-cel引导一种名为Cas9的酶到一个名为BCL11A的基因,该基因通常阻止身体产生一种仅在胎儿中发现的血红蛋白。Cas9通过切割BCL11A的DNA,使其在骨髓干细胞(红细胞的产生地)中失活,细胞开始产生胎儿血红蛋白并创建具有正常圆形形状的红细胞。在新疗法中,医生取出患者自身的骨髓干细胞,用exa-cel对其进行编辑,破坏患者剩余的未经治疗的骨髓,然后重新输注编辑后的细胞。
由于这些编辑后的细胞最终会重新populate身体,exa-cel被认为是一种“治愈性”疗法,理论上将持续接受者余生,尽管Vertex和CRISPR Therapeutics对他们的大部分试验参与者的随访时间不到两年。
治疗效果如何?
到目前为止,exa-cel仅在约100名患有镰状细胞贫血症或β-地中海贫血症的人身上进行了测试。尽管如此,FDA在2019年还是给予了这些公司“快速通道”批准,允许他们在比通常要求更小的人群中测试该疗法。
在这些仍在进行的试验中,30名镰状细胞贫血症研究参与者中有29人在接受exa-cel输血后的18个月内,一年内没有疼痛。42名β-地中海贫血症患者中有39人在接受exa-cel干预后一年内不再需要输血或骨髓移植(该疾病的标准治疗方法)。Vertex和CRISPR Therapeutics正在继续追踪尚未达到此时点的剩余参与者,并将对所有参与者进行长达15年的随访。
有哪些风险?
提交给FDA的结果表明,exa-cel没有重大的不利健康影响,尽管它可能会引起恶心和发烧等副作用。但德保恩指出,参与者仅被追踪了很短的时间,问题可能会在以后出现。
FDA提出的另一个担忧是,Cas9酶可能保持活性并在BCL11A以外的位点切割基因组,从而产生所谓的脱靶突变。这些公司模拟了酶可能切割的基因组中最可能的位置,但没有发现证据表明这在试验参与者中发生过。“鉴于任何新疗法,我们仍然保持谨慎乐观,”德保恩说。
除了exa-cel,还有哪些其他有前景的镰状细胞病疗法?
Bluebird bio的lovo-cel是今天获得FDA批准的另一种基因疗法,它使用病毒载体递送成人血红蛋白生成基因的功能版本,并将其永久插入人体基因组。Bluebird bio提交给FDA的数据显示,lovo-cel对36名受试者有效,这些受试者接受了平均32个月的随访。数十项研究正在调查其他类型的镰状细胞贫血症和β-地中海贫血症基因疗法,这些疗法将正常版本的HBB或其他基因递送到体内。
研究人员发现,一种称为半相合移植的技术也可以治愈镰状细胞贫血症。在这种疗法中,人的骨髓细胞被替换为来自父母或兄弟姐妹的骨髓细胞,后者在基因上与接受者有50%的相同,但没有该疾病。这种疗法已广泛用于治疗某些癌症。将在下周美国血液学学会年会上公布的结果显示,88%接受这些移植的成年人在两年后继续产生正常的红细胞。德保恩表示,这项技术在低收入和中等收入国家可能特别有用,因为它可能比基因编辑或基因疗法便宜得多。
exa-cel或lovo-cel是否适用于所有镰状细胞病患者?
与大多数基因编辑疗法一样,exa-cel和lovo-cel可能非常昂贵。Vertex、CRISPR Therapeutics和bluebird bio均未说明各自疗法的费用,但估计每种疗法的价格可能高达每位患者200万美元。目前尚不清楚保险公司,特别是医疗补助等政府服务机构,是否会承保这些疗法,或者在哪些情况下会承保。镰状细胞病对非洲裔人口(包括非裔美国人)的影响尤为严重,与美国大多数其他群体相比,他们更有可能通过医疗补助获得公共保险。
德保恩表示,决定是采用CRISPR基因编辑还是其他方法(如半相合移植)需要由患者、其家人和医生共同决定。即使基因编辑被证明在永久治愈该疾病方面更有效,它也可能不如供体移植那样普及,并且可能需要更长的时间。
尽管如此,德保恩表示,exa-cel是一个良好的开端,他预计随着未来十年对CRISPR疗法的了解不断深入,这项技术将得到改进。“这只是马拉松的第一英里,”他说。