新加坡、台湾和香港在限制严重急性呼吸综合征冠状病毒 2 (SARS-CoV-2) 的影响方面取得了非凡的成功,这表明通过对大流行准备工作的大量投资,有可能对疫情做出有效反应。尽管与中国邻近,但这三个地区已设法将病例数和死亡人数保持在较低水平。通过从先前这些地区首当其冲的冠状病毒爆发中吸取教训,他们能够迅速部署广泛的检测,将其与数字监控相结合以追踪个人的活动,并在可疑病例中实施严格的隔离,此外还建立了大量的个人防护装备储备。
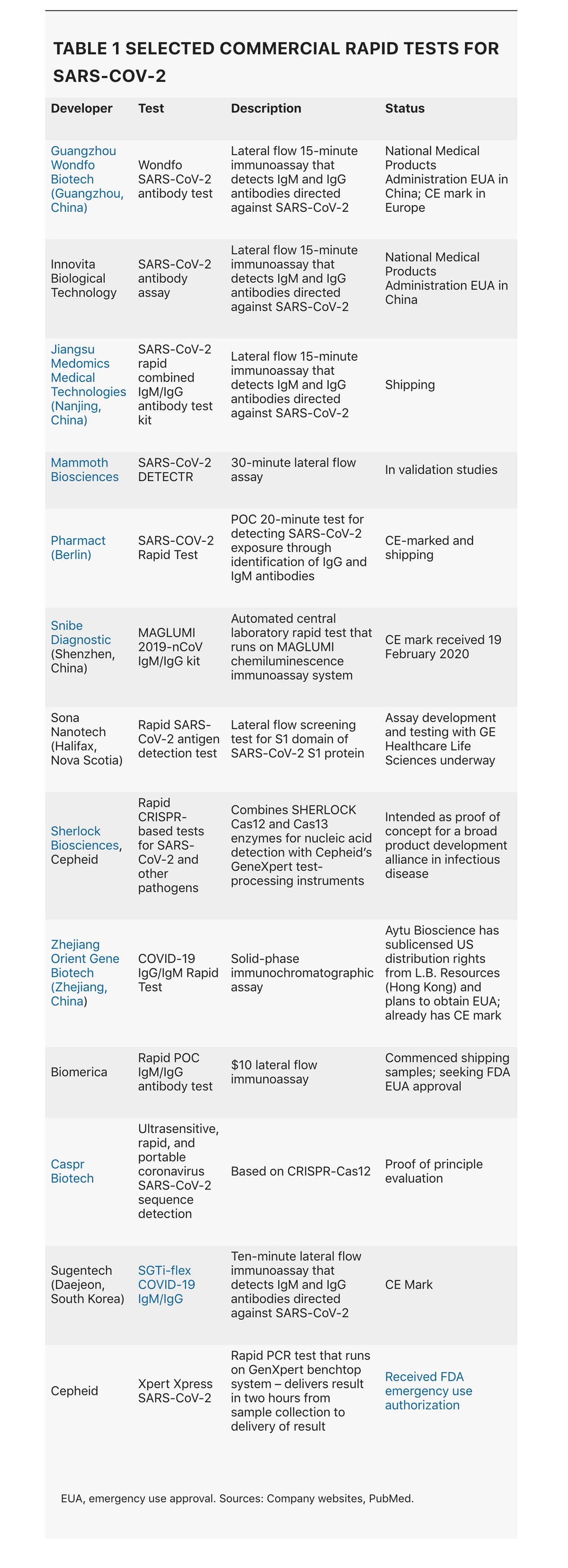
在世界其他地方,大多数国家都对病毒的猛烈袭击毫无准备。因此,在有足够的检测来允许隔离和追踪之前,许多医疗保健系统已经面临社区传播。尽管公共卫生部门采取了严厉的措施和隔离策略,但在验证、实施和分发 SARS-CoV-2 诊断测试以及建立分散的即时(POC)检测方面,许多部门都措手不及。现在,这种情况开始发生变化,第一批此类测试(表 1)已经开始运送。更重要的是,目前的危机可能是基于 CRISPR 技术的诊断方法的一个决定性时刻——基于 CRISPR 基因编辑技术的第一个诊断测试可能仅需几周即可问世。然而,为了阻止病毒传播,需要大规模努力扩大易于使用的 POC 测试的生产,然后广泛部署它们。
到目前为止,对 SARS-CoV-2 爆发的第一线反应是聚合酶链反应 (PCR) 检测。PCR 是诊断传染性病原体的金标准,它的优势在于,一旦已知病毒序列,就可以相对快速地生产此类检测所需的引物。世界卫生组织 (WHO) 于 1 月份在识别出该病毒后不久,设计并分发了第一批用于检测 SARS-CoV2 的定量逆转录酶 PCR (RT-PCR) 检测。然而,该测试协议复杂且昂贵,主要适用于大型集中式诊断实验室。测试通常需要 4-6 小时才能完成,但运输临床样本的后勤要求意味着周转时间最快也要 24 小时。在美国,美国疾病控制中心选择开发自己的测试,而不是采用世界卫生组织的测试。美国食品和药物管理局在授权公共卫生或医院实验室运行测试方面的拖延,疾病控制中心在 2 月初开发和分发的初始 RT-PCR 测试中使用的一种试剂出现故障,以及 RNA 提取试剂的短缺,进一步延迟了全国范围内的测试推广。
关于支持科学新闻
如果您喜欢这篇文章,请考虑通过以下方式支持我们屡获殊荣的新闻报道 订阅。通过购买订阅,您将有助于确保有关当今世界重大发现和塑造我们世界的想法的有影响力的故事的未来。
尽管存在这些缺点,但多重 RT-PCR(同时检测多个目标序列)仍将是检测的支柱,尤其是在集中式实验室中。罗氏诊断、赛默飞世尔科技、凯杰(即将被赛默飞世尔收购)和奎斯特诊断等大型供应商正在通过推出自动化 SARS-CoV-2 检测系统和服务来提高执行此类检测的能力。
还需要 POC 测试来加速临床决策并减轻集中式测试实验室的一些工作量。上个月在日内瓦召开的世界卫生组织专家组确定了在社区层面使用的快速 POC 测试是八项研究优先事项中的第一项。支持向低收入国家开发和交付诊断方法的日内瓦非营利组织创新新诊断基金会 (FIND) 正在通过邀请化验开发人员提交其产品进行独立评估来帮助这项广泛的努力。它已收到 220 份提交的材料,正在进行评估,并将在本月底之前与符合条件的制造商联系。FIND 还编制了一份广泛的 SARS-CoV-2 诊断开发人员名单,其中主要是开发基于 PCR 的核酸检测或免疫分析的公司。新加坡国立大学邵逸夫公共卫生学院也在密切跟踪商业公司和学术实验室的诊断开发情况。
免疫分析可以提供有关病毒暴露的历史信息以及诊断证据。它们利用抗体-抗原识别,或者通过使用单克隆抗体 (mAb) 检测临床样本中的病毒抗原,或者通过使用克隆的病毒抗原检测患者针对该病毒的抗体。侧向流动分析形式(本质上是一个装在盒式磁带中的试纸)包含固定在硝化纤维素膜上特定位置的捕获试剂(针对病毒抗原的 mAb 或患者抗体识别的病毒抗原),以及识别相同目标的标记检测器 mAb。阳性结果是由分析物与捕获 mAb 之间的结合以及检测器 mAb 的结合触发的,可见为一条彩色线。从针刺中取出的两滴血就足以检测到病毒。它们本质上与家用验孕试剂盒相同。
然而,PCR 和免疫分析技术都不是理想的。PCR 测试非常准确,可以快速开发,但它们使用复杂,并且交付结果的速度很慢。免疫分析的准确性较低,开发时间较长,但它们易于使用,并在 20-60 分钟内提供结果。而且,由于免疫分析检测患者对病原体的抗体,因此它们必然必须应对多克隆人类抗体反应的固有变异性。“这种抗体反应需要时间来表征,”FIND 首席科学官 Ranga Sampath 说。因此,在验证测试期间获得的结果不一定能在临床环境中复制。“这些测试往往不是最终的——这是免疫分析的最大挑战,”他说。
即便如此,免疫分析的速度和多功能性使其成为宝贵的测试;而且大规模生产它们的努力正在开始加强。台湾台北中央研究院基因组研究中心的研究员杨安遂及其同事声称是第一个开发出针对 SARS-CoV-2 核衣壳 (N) 蛋白的 mAb 的人,该 mAb 可以构成快速抗原测试的基础。它还产生了识别 SARS-CoV-2 和原始 SARS-CoV N 蛋白或仅 SARS-CoV N 蛋白的其他抗体。没有 mAb 与其他人类冠状病毒株的核衣壳蛋白结合。“如果成功制造和验证,快速的基于免疫的检测试剂盒可以在 20 分钟内检测出冠状病毒抗原,而无需仪器和经过培训的人员,其成本和效用与快速流感 LFIA [侧向流动免疫分析] 测试相当,”他说。杨的团队仅用了 19 天就完成了这项壮举,他们使用了抗体-抗原相互作用的人工智能模型,他们用它来生成人工抗体库。预测的抗体 DNA 可以化学合成,并且可以在细菌中的噬菌体展示系统中表达产生的 mAb。避免免疫动物以获得单克隆抗体,然后必须对其进行结合活性分类(传统方法)可将通常的时间缩短大约两个月。该小组目前正在开发 LFIA 设备的原型,但也希望将抗体组授权给第三方。
对于其免疫分析,位于新斯科舍省哈利法克斯的 Sona Nanotech 选择了 SARS-CoV-2 刺突蛋白的 S1 域作为其正在与 GE Healthcare Life Sciences 合作开发的基于抗原的 LFIA 的基础。刺突 (S) 蛋白通过结合表达在其表面的血管紧张素转换酶 2 (ACE2) 来促进病毒进入气道上皮细胞。“我们预计将在未来六到八周内推出仅供研究使用的产品,”首席执行官 Darren Rowles 说。除此之外,该公司还计划为下一个北半球流感季开发一种双重产品,该产品将在单次测试中结合 SARS-CoV-2 和流感病毒检测。
与检测病毒本身的测试相比,检测患者体内针对 SARS-CoV-2 的多克隆抗体的测试开发速度更快,因为它们仅包含固定的重组病毒抗原(比针对该病毒的 mAb 更容易产生)。它们还提供与基于 mAb 的测试相似的准确度水平。
总部位于柏林的 Pharmact 已经开始发运一种 20 分钟的免疫分析,其中包含三种 SARS-CoV-2 抗原:N 蛋白以及 S 蛋白的 S1 和 S2 域。它旨在检测任何识别这些蛋白质结构的患者抗体。其目标是在 4 月份将产量扩大到 100 万次测试。与此类测试的典型情况一样,它检测在感染的初始和后期分别释放的免疫球蛋白 (Ig) M 和 IgG 抗体。它进行了验证研究,将测试结果与 PCR 进行了比较,使用了来自 114 名感染患者和 126 名未感染对照的样本。该测试在特异性方面得分很高。“我们的真阴性率为 100%——零假阳性,”Pharmact 的医学主任 Gunther Burgard 说。然而,它的灵敏度较低,因为 IgM 反应没有提供强烈的初始信号。在感染的早期阶段(第 4-10 天),该测试的 IgM 部分的灵敏度仅为 70%。在第 11 天到第 24 天之间,灵敏度迅速上升到 92.3%,并且在该感染阶段,该测试的 IgG 部分的灵敏度为 98.6%。Burgard 说,总体而言,该测试的假阴性率为 13%。
将分散式检测与流行病学监测相结合,将进一步增强公共卫生部门对抗 SARS-CoV-2 爆发的能力。由华盛顿大学领导的西雅图流感研究正在将一种创新方法应用于当前的危机,该方法旨在在全市范围内追踪季节性流感爆发。出现呼吸道症状的参与者可以电子方式请求鼻拭子试剂盒,该试剂盒由快递员送达。招募、同意和数据收集均以电子方式进行,但该协议依赖于集中式实验室检测,而不是即时检测(POC)。在芬兰,一项研究表明,通过将自动化即时检测与实验室信息系统相结合,可以实现实时流行病学监测。由芬兰图尔库的 ArcDia 公司开发的即时检测系统 mariPOC Respi 现在通过云传输数据。它目前涵盖十一种呼吸道病原体,包括十种病毒(其中包括冠状病毒 OC43,三种仅引起轻微疾病的人类冠状病毒之一)和一种细菌。该公司现在计划在几个月内将 SARS-CoV-2 纳入其检测范围。mariPOC Respi 系统不是高通量设备:它依赖于一台台式分析仪,每天可以处理大约一百个样本,但试剂成本约为 PCR 检测的三分之一。它主要面向社区环境,例如大型初级保健中心。尽管它在芬兰拥有 50% 的市场份额,但到目前为止在其他地方的普及程度有限。“核心实验室更喜欢多重 PCR,”ArcDia 公司战略与业务发展高级副总裁 Aleksi Soini 说。这些设施的负责人是诊断领域的意见领袖,他们不愿放弃对分散式检测制度的控制权。“这是一个结构性问题,”Soini 说。Scanwell Health 正在准备推出一种更加分散的检测——一种送货上门的免疫测定和配套的智能手机应用程序,这将允许用户与医生或执业护士分享结果。它已获得中国唐山 Innovita Biological Technology 公司的抗体免疫测定的美国权利(表 1)。
当然,PCR 是基于现在已经有几十年的科学发展而来的。Mammoth Biosciences 和 Sherlock Biosciences 是分别由 CRISPR 先驱 Jennifer Doudna 和 Feng Zhang 共同创立的公司,它们都旨在通过利用 CRISPR-Cas 编辑的特异性和敏感性来开发快速的 POC SARS-CoV-2 检测,从而在实现真正的 POC 检测速度的同时,达到 PCR 的准确性。Mammoth 的科学家与来自加利福尼亚大学旧金山分校和加利福尼亚州公共卫生部的合作者最近报告了其 SARS-CoV-2 DETECTR 的设计和性能,该检测是一种横向流动检测,耗时 30 分钟——或者包括 RNA 提取步骤在内大约 45 分钟。该测试采用病毒 RNA 的同步逆转录和环介导扩增,这是一种简化的核酸扩增技术,使用 PCR 式引物,但不需要重复的加热和冷却循环。然后将扩增的核酸与靶向 SARS-CoV-2 包膜 (E) 和 N 基因序列的引导 RNA (gRNA) 分子以及 lbCas12a 酶一起孵育,该酶在 gRNA 介导的靶位识别后,会无差别地切割附近的单链 DNA (ssDNA)。这允许添加基于 ssDNA 的报告分子,以确认病毒 RNA 的存在。
根据对来自 6 名感染 SARS-CoV-2 的患者、来自 12 名感染季节性流感或引起轻微症状的三种冠状病毒毒株(OC43、HKU1 和 NL63)的患者以及来自 5 名健康志愿者的样本进行的 RT-PCR 初始验证测试,该检测的阳性预测值为 100%,阴性预测值为 91.7%。“我们正处于额外验证的中间阶段,”Mammoth 联合创始人兼首席执行官 Trevor Martin 说。该公司旨在尽快运送该检测。“在理想情况下,是几周,而不是几个月,”他说。它被专门设计为具有简化的试剂,以便于制造。“除了 CRISPR 蛋白本身之外,你使用的东西没有太特别的地方,”他说。冻干试剂并开发用于运行测试的便携式微流控芯片盒将使其能够在实验室环境之外进行部署。
Sherlock Biosciences 也在研究几项 SARS-CoV-2 计划。“拥有快速部署的技术是一回事,”Sherlock 首席执行官兼联合创始人 Rahul Dhanda 说,但“要将一项检测推向市场,需要的不仅仅是让检测起作用。”该公司旨在利用合作伙伴来获得他们的监管专业知识以及制造和分销能力。它已与 Cepheid 建立了联盟,为一系列传染病(包括 COVID-19)开发基于 CRISPR 的检测,这些检测将在后者的 GeneXpert 自动化分子诊断系统上运行。在当前危机爆发之前,双方已经在讨论合作关系,但将 SARS-CoV-2 纳入其中是显而易见的一步。鉴于当前危机的紧迫性,Sherlock 也在调查是否可以在更短的时间内将更简单的检测推向市场。“我们开始与试剂盒制造商接触,以确定我们是否可以组装一个试剂盒,”Dhanda 说。“我们需要考虑的是急性反应和全面的应对措施。”
鉴于当前大流行病发展轨迹的不确定性,目前尚不清楚 CRISPR 技术是否将为全球追踪 SARS-CoV-2 进展的努力做出重大贡献。但对这种技术的需求似乎迫在眉睫。“这暴露了分子诊断市场的一个巨大差距,”Martin 说。这只是大多数国家为应对病毒大流行病所做的准备工作中的众多差距之一。
本文经许可转载,于 2020 年 3 月 24 日首次发表。
在此处了解更多关于冠状病毒爆发的信息。
