那是在耶路撒冷的午夜,我们正在观察小鼠游泳。那是1994年,我们两人蹲在希伯来大学实验室的一个冷水池旁。房间很冷,我们弓着背,腰酸背痛,而且我们已经连续多个晚上重复这个例行程序,所以我们又累又不舒服。小鼠也是如此。小鼠真的不喜欢游泳,尤其是在冷水中——但我们想让它们感到压力。
我们人类上夜班是因为我们两人白天都有其他事情要做。考弗正在攻读分子神经生物学博士学位,弗里德曼是以色列国防军的医生,经常值班。每天晚上把我们和小鼠聚集在一起的是试图理解一个医学谜团:海湾战争综合征。在1991年冲突结束后,越来越多的报告称,美国领导的联军士兵患有慢性疲劳、肌肉疼痛、睡眠问题和认知能力下降,这些士兵的住院率高于未部署的退伍军人。一些医生怀疑,给予士兵以保护他们免受化学武器侵害的吡啶斯的明,如果进入他们的大脑,可能会导致这些疾病。
然而,这个理论存在一个大问题:血液中的吡啶斯的明不应该到达大脑。穿过这个重要器官的血管的壁由特殊的细胞构成,这些细胞紧密排列,并具有选择性控制什么可以进入大脑的能力。它们形成了一个屏障,将毒素、细菌和病毒等病原体以及大多数药物安全地保留在血管内。这种结构被称为血脑屏障,简称 BBB,这种药物本不应该能够穿过它。
支持科学新闻报道
如果您喜欢这篇文章,请考虑支持我们屡获殊荣的新闻报道,方式是 订阅。通过购买订阅,您正在帮助确保有关当今塑造我们世界的发现和想法的具有影响力的故事的未来。
也就是说,如果屏障完好无损。我们正在测试以下假设:战斗的身心压力可能会以某种方式引发屏障泄漏。游泳的小鼠是我们测试压力是否会导致损伤的方法。当游泳结束后,我们把每只小鼠从水池中拉出来,并将一滴蓝色染料注射到它的一根静脉中。然后我们等待染料通过它的身体,逐渐将小鼠变成蓝色。如果 BBB 完好无损,那么大脑应该保持其正常的粉白色。我们对小鼠实施了安乐死,以便我们可以在解剖显微镜下观察它们的大脑。在几个晚上,我们尝试了各种游泳时间长度,但我们没有看到任何大脑变化。
但在这一晚,在两次稍冷的水中浸泡后,情况看起来不同了:大脑呈现出强烈的蓝色!实验室工作通常是乏味的,成功往往是微妙的,但这一次我们兴奋得跳上跳下,互相拥抱。我们奇怪的实验奏效了。压力大的情况可能会使 BBB 出现泄漏。在我们的导师,神经科学家 Hermona Soreq 的帮助下,我们继续证明这种效应发生在吡啶斯的明身上,并改变了脑细胞的活动。我们在 1996 年的《自然医学》和 1998 年的《自然》杂志上发表了这些结果。
四分之一世纪后,我们可以说,观察这些蓝色大脑原来是我们两人职业生涯的决定性时刻,也是终身友谊和科学合作的开始。发现明显的蓝色色调是在多年来引导我们越来越深入地探究其他脑部疾病与器官保护壳缺陷之间联系的道路上的第一步。今天,吡啶斯的明渗透是海湾战争综合征病因的主要假设,尽管还有其他候选病因。我们的研究已将 BBB 损伤(由衰老以及损伤或急性应激引起)与几种更常见的疾病联系起来:阿尔茨海默病和相关痴呆症、癫痫和创伤性脑损伤。在 2019 年发表在《科学转化医学》杂志上的两篇论文中,我们证明,随着人们年龄的增长,这个保护罩会失去完整性并开始泄漏,从而使通常不会到达那里的血液蛋白质进入大脑。这些蛋白质反过来会激活脑细胞之间的一系列事件,这些事件会产生一些与衰老和疾病相关的最显著和最广泛的变化:炎症、异常神经元活动和认知障碍。
因果关系看起来尤其强烈,因为阻止这些泄漏引发的反应实际上可以逆转疾病迹象,至少在啮齿动物中是这样。在老年小鼠中,我们可以通过靶向药物消除炎症雾,这种药物可以保护脑细胞免受血液蛋白质的刺激,或者通过基因改造来阻止这些细胞释放炎症分子。在治疗的几天内,这些小鼠的衰老大脑开始更像年轻大脑一样运作。异常的电活动消退了。炎症标志物降至低水平。当放入迷宫时,这些动物像年轻小鼠一样快速而准确地通过迷宫。我们不能在人类身上尝试相同的实验性大脑改造;这不符合伦理道德。但是,我们已经能够使用磁共振成像技术、脑电图记录和尸检脑标本分析来比较老年人和阿尔茨海默病患者的大脑与年轻人和健康人的大脑。图像显示,随着年龄的增长以及患有该疾病的人,BBB 破坏和泄漏过度且逐渐加重,以及化学级联反应的其他特征。
我们不知道受损的屏障是否是阿尔茨海默病或其他脑部疾病的唯一原因。它可能与其他原因(包括遗传学和在衰老大脑中观察到的各种细胞问题)一起发挥作用。或者它可能是附带损害。而且,在小鼠身上进行的实验通常不会在人身上奏效。但是,目前,关于阿尔茨海默病的长期的主导理论——即它是由大脑中一种名为 β-淀粉样蛋白的蛋白质积聚引发的——看起来比以往任何时候都更缺乏说服力。许多人的大脑中 β-淀粉样蛋白水平很高,但没有表现出精神功能下降。此外,许多实验已经降低了大脑中这种蛋白质的水平,但该疾病和相关的精神衰退仍然没有受到影响。靶向 β-淀粉样蛋白的药物未能提供帮助。鉴于世界卫生组织的数据显示,目前全球有超过 5500 万痴呆症患者,并且每年诊断出近 1000 万新病例,许多科学家表示,现在是考虑替代解释和治疗方向的时候了。如果大脑保护罩的缺陷启动了一系列导致疾病的事件——实验表明,可以阻止这一系列事件以恢复大脑健康——那么这是一条值得追求的调查途径。
墙壁上的裂缝
BBB 的名称中带有“屏障”二字,听起来像是大脑周围的一堵墙,但它实际上更像是一个分布式过滤器。我们身体的控制中心获得了心脏泵出的富氧血液的 20%,这些血液由错综复杂的血管网输送。它们看起来与身体其他部位的血管不同,它们的壁由紧密排列的细胞构成,具有特定的运输系统,形成半透膜过滤器。脑细胞网络需要一个受到严格控制的环境才能发挥作用,因此这种过滤器允许氧气和葡萄糖等分子扩散通过,但会阻挡血液蛋白质、某些离子、免疫系统细胞和病原体。这种保护性网格遍布大脑的大部分区域,从负责高阶认知的皮层外层到调节记忆存储的海马体等深层区域。因此,过滤器出现问题可能会导致各种神经系统问题。
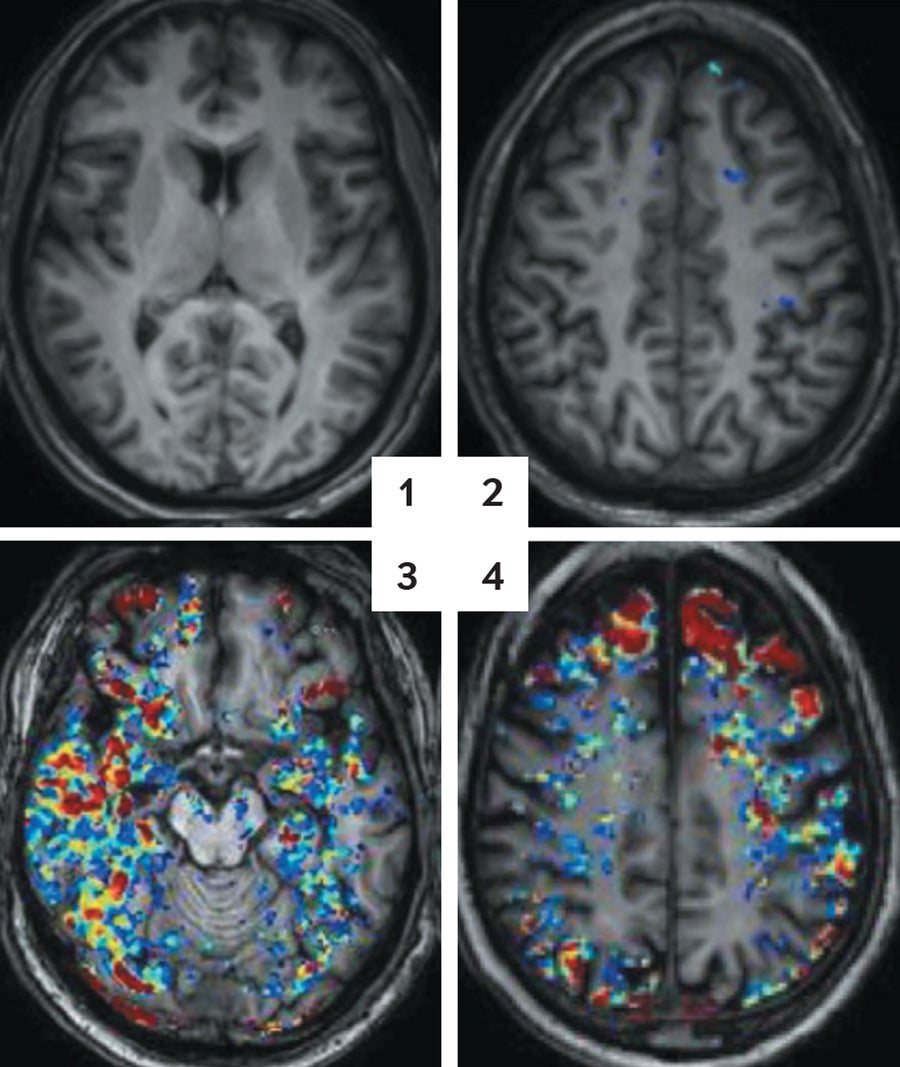
衰老的屏障:脑部扫描突出显示血液中的彩色示踪分子,显示随着人们年龄的增长,血脑屏障泄漏更多。 30 岁的人看起来很清晰 (1)。 42 岁时,蓝色斑点表示少量渗漏 (2)。 到 65 岁时,红色和黄色斑点显示更大的流量 (3)。 76 岁时,这种模式仍在继续 (4)。 信用:Alon Friendman 和 Daniela Kaufer
早在 20 世纪 90 年代,当我们完成关于海湾战争综合征的初步工作时,我们就知道其他研究人员已经注意到一些脑部疾病(包括阿尔茨海默病)患者的 BBB 损伤。但我们不知道这个问题是原因还是结果,也不知道屏障中的泄漏是如何开始的,以及它们可能会如何改变大脑功能。但是,我们确实想找出答案。
在耶路撒冷工作一段时间后,考弗去了斯坦福大学做博士后研究员,弗里德曼继续他在以色列的医学培训,专攻神经外科。但时间和距离并没有让我们忘记。在与家人一起度假,在希腊岛屿之间航行时,我们赶上了进度。考弗在斯坦福大学的工作中更多地了解了压力如何影响小鼠的大脑。弗里德曼在他自己的实践中,再次证实了其他研究人员的早期观察,他们发现许多患有非常不同的神经系统疾病的患者的 BBB 存在缺陷。受损的屏障到底在做什么?
在 2000 年代中期,当弗里德曼有机会在柏林与已故的神经科学家 Uwe Heinemann(神经生理学研究所,夏里特基础医学中心的一部分)一起工作时,我们开始弄清楚这个问题的答案。海因曼向下一个关键实验敞开了他的实验室。我们想在 BBB 开始发生故障后直接观察大脑功能,因此我们给大鼠注射了一种化学物质,这种化学物质实际上在屏障上戳了洞,然后在稍后的不同时间解剖了它们的大脑。我们将大脑切片保存在滋养液中,并使用电极记录细胞在屏障泄漏的情况下用于相互交流的电信号。
最初的几天很无聊。神经元以断断续续、不规则的模式一个接一个地发出信号,“交谈”得好像什么不寻常的事情都没有发生一样。我们几乎决定放弃。然后,在第五天,细胞的喋喋不休模式发生了变化。越来越多的神经元开始同步地一起搏动。整整一周后,我们用来自电极的小信号轻推它们,模拟大脑皮层内的短暂电信号。这种轻推产生了一场细胞一起放电的风暴,类似于在癫痫病人和动物身上观察到的情况。
我们认为这些细胞发生的事情类似于产生 Twitter 风暴。想象一下,您今天创建了一个 Twitter 帐户并发布了一些耸人听闻的声明。您可能会得到非常小的回应,因为您不会有很多关注者。但是,如果在接下来的几天里,您建立了一个更大的关注者网络并再次发推文,那么相同的声明很可能会被转发,从而招募更多的关注者,他们也会转发它,最终导致社交媒体平台上的推文风暴。类似地,当我们破坏 BBB 时,大脑中的神经元并没有立即被打乱,但在它们花了一个星期建立新的连接网络后,一个小小的震动引发了更大的电反应。我们现在已经在被诊断患有阿尔茨海默病和癫痫病的人的大脑中记录了这些电反应,并将这些事件称为“阵发性慢波事件”。
这场风暴只在我们模拟 BBB 泄漏后才会发生。如果没有泄漏,我们的大脑切片就不会受到任何电风暴的困扰。因此,我们假设血液中存在某种元素,它到达这些神经元以触发大脑反应。我们通过将血液直接注射到年轻、健康且 BBB 正常的大鼠的大脑中(绕过屏障)并监测电活动来测试这一理论。这花了好几天时间,但风暴再次酝酿并爆发。显然,这与血液有关。但是血液是一种复杂的液体,包含许多不同种类的细胞和蛋白质,因此我们开始了一项艰苦的过滤和捕获远征。我们使用各种过滤器来捕获不同大小的血液成分,然后重复注射以查看风暴是否再次发生。这是一个排除过程。最终,我们发现了一种会产生干扰的血液蛋白质:白蛋白。
麻烦的开始
我们对我们的发现并不感到兴奋。白蛋白非常常见,并且参与许多身体功能,因此很难确定它在这种情况下在做什么。我们本来更喜欢一种更稀有的成分。但白蛋白是我们得到的,所以我们深入研究。考弗搬到加州大学伯克利分校,经营自己的实验室,弗里德曼开始了他的实验室,最初在以色列内盖夫本-古里安大学,后来在加拿大新斯科舍省达尔豪西大学。我们计划在几年内进行一系列联合的远程实验,以描述从 BBB 破坏和白蛋白泄漏到神经系统疾病出现的过程步骤。
我们学到的第一件事是,当白蛋白进入大脑时,它似乎会刺激星形胶质细胞,星形胶质细胞是关键的脑细胞,为神经元及其连接提供结构、功能和化学支持。当白蛋白接触星形胶质细胞时,它会与细胞上的受体结合,这些受体在正常情况下会结合一种名为转化生长因子 β (TGFβ) 的信号分子。除其他外,TGFβ 会引发炎症,启动称为细胞因子的分子级联反应,并激活星形胶质细胞和称为小胶质细胞的哨兵细胞。通常,这种机制是大脑限制损伤的方式,通过有针对性地摧毁功能失调的细胞。但是,当白蛋白渗入时,它会导致 TGFβ 和其他细胞因子的过度产生形成正反馈循环,从而启动一系列事件。最近的证据描述了“衰老”细胞——细胞增殖功能停止后仍保持化学活性的细胞——它们检测组织损伤并开启一种基因程序,该程序会放大信号,并将其广播给邻近细胞。我们在今年发表在《衰老细胞》杂志上的一篇论文中表明,渗入大脑的白蛋白会诱导星形胶质细胞衰老。最终,许多脑细胞受损,关键的神经连接被修改,这些回路的功能恶化。
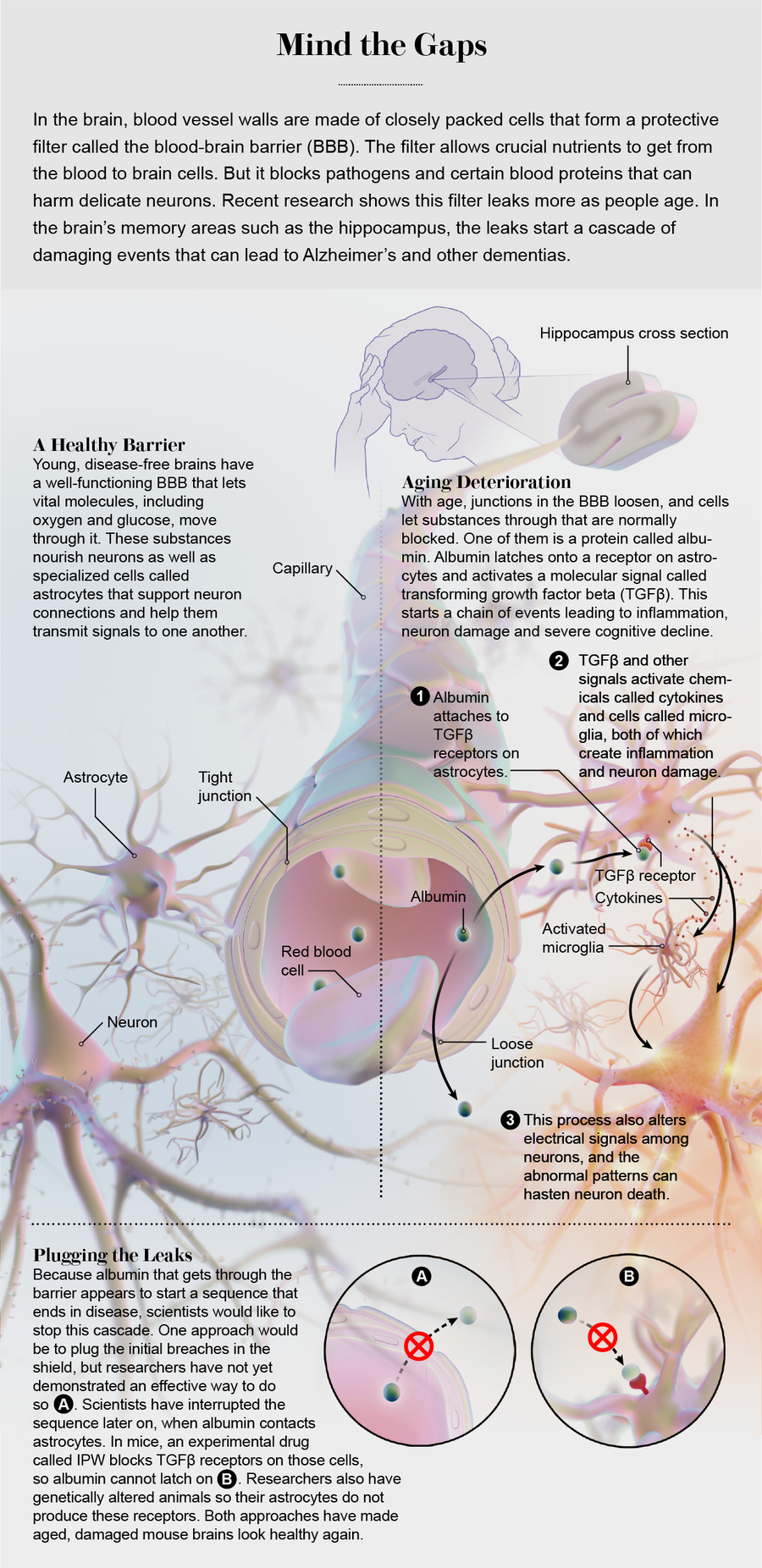
信用:Now Medical Studios
这些发现追踪了从 BBB 泄漏(例如由脑损伤引起)到神经功能障碍和癫痫可能发展的步骤。我们开始好奇这是否为某些个体大脑功能随年龄增长而退化提供了一种可能的解释,事实上,随后的实验表明,这一系列事件是如何在衰老小鼠中发生的。这些动物的平均寿命通常略超过两年。我们让一群小鼠平静地衰老,并在不同时间点观察它们的大脑内部。我们看到,白蛋白在年轻小鼠的大脑中根本不存在,但在中年时开始出现。这种影响最初是轻微的,但屏障的完整性明显下降,并且在一些小鼠中随着年龄的增长而变得更糟。受影响的小鼠在学习和记住通过迷宫的路径方面也比它们年轻且相对无白蛋白的同类小鼠更困难。
当白蛋白出现时,其他实验表明,TGFβ 受体开始变得活跃。我们用识别 TGFβ 受体激活的炎症蛋白副产物的抗体对小鼠大脑进行染色,然后我们使用绿色荧光来定位具有白蛋白和 TGFβ 受体过度活跃的星形胶质细胞。炎症信号始终在白蛋白出现在星形胶质细胞中之后开始,并且随着白蛋白泄漏程度的增加而增加。我们看到白蛋白及其引起的炎症在海马体中尤其丰富,海马体是记忆调节的关键组成部分。
在过去的十年中,我们已经能够提供充分的证据表明,同样的过程发生在人类身上。我们使用示踪分子来标记人体屏障泄漏的信号。通过 MRI,我们可以看到当示踪剂在注射后几分钟出现时,大脑如何改变其信号。与小鼠类似,一些中年人已经显示出示踪剂在那时泄漏到他们的大脑中,并且年龄越大的人,他们的屏障泄漏得越严重。其他研究人员,例如南加州大学凯克医学院的 Berislav V. Zlokovic 和他的同事,使用略有不同的成像方法来显示认知障碍的活人海马体中类似的与年龄相关的屏障完整性下降。在我们的工作中,我们添加了另一组人的尸检,并表明白蛋白水平升高伴随着更高量的 TGFβ,始终在星形胶质细胞中。这些浓度在老年人和死于阿尔茨海默病的人中高于没有该疾病的人。
大脑再生
现在我们知道,衰老小鼠的 BBB 功能障碍与人类的过程之间存在相关性。但是证明相关性并不能证明因果关系。首先,我们证明了这种机制足以激活大脑中的衰老程序:当我们将白蛋白注入年轻小鼠的完整健康大脑一周时,这些大脑的功能就像衰老的大脑一样,具有异常的神经元功能、更高的癫痫发作易感性和降低的学习能力(小鼠很难学习水迷宫任务中的逃生路线)。此外,这种机制的激活对于衰老反应至关重要:我们通过阻断泄漏后发生的白蛋白-TGFβ 级联反应来逆转小鼠的退化。我们开发了一组小鼠,我们在这些小鼠中通过基因剪切掉告诉星形胶质细胞产生 TGFβ 受体的 DNA 部分,从而从细胞中消除了该特征。当小鼠还相对年轻时,我们在它们的大脑中植入了一个微型泵,该泵注入白蛋白。我们对一组年轻的正常小鼠也做了同样的事情。然后,我们将这两组放入一个棘手的水迷宫中。(观察小鼠游泳似乎是我们反复出现的主题。)具有受体(以及大脑中白蛋白)的小鼠遇到了很多麻烦。但是,没有受体的动物像年轻、健康的小鼠一样快速而准确地游过迷宫——而且当我们改变迷宫配置时,它们也学会了新的路线。当我们观察它们的大脑时,我们看到了低水平的炎症、衰老的星形胶质细胞和异常的电活动。
这真的非常令人鼓舞。但是对于人类来说,敲除大脑特征基因的选择在短期内不会成为可用的疗法。然而,还有另一种治疗形式。Barry Hart 是加利福尼亚州帕洛阿尔托市一家初创制药公司 Innovation Pathways 的药物化学家,他设计了一种抗癌药物,专门阻断 TGFβ 受体的活性。这种生长因子在肿瘤进展中发挥作用,因此阻断它们可能具有治疗作用。哈特联系了我们,并建议我们在我们的小鼠身上试用这种名为 IPW 的药物。
当我们给中年小鼠——那些开始出现白蛋白泄漏的小鼠——服用这种药物时,我们了解到它使它们的大脑看起来又年轻了。 TGFβ 活性降至年轻小鼠的水平,炎症标志物大幅下降,异常的电活动和癫痫发作易感性降低。
但最大的惊喜来自我们测试实际行为和认知时。我们设置了另一个迷宫,这次我们让老年小鼠通过它。一些老年动物接受了 IPW 治疗,一些没有。我们没有预测会有很大的改善,因为我们认为不可逆转的损害已经造成。(我们没有 TGFβ 基因的小鼠幸免于炎症级联反应造成的长期退化,但这些动物没有。)然而,在几天之内,接受治疗的小鼠在学习迷宫方面几乎与它们年龄一半的啮齿动物一样出色。未接受治疗的小鼠像往常一样蹒跚而行。此外,接受 IPW 治疗的小鼠没有表现出我们在阿尔茨海默病或癫痫病患者身上通常看到的“Twitter 风暴”效应,也没有太多炎症迹象。就好像炎症雾已经消散,让大脑重新获得了青春的能力。这些以及对人脑的研究是我们 2019 年在《科学转化医学》杂志上的两篇论文中发表的结果。
迷宫结果如此出乎意料,甚至对我们来说也是如此,因为像大多数人一样,我们认为衰老损伤是一条单行道——无法逆转的退化。对于主要的大脑问题,例如帕金森病患者或晚期阿尔茨海默病患者一旦 β-淀粉样蛋白积累到足以杀死大片神经元和其他细胞的程度时发生的破坏,情况可能就是如此。但这项工作可能表明,在没有大量细胞死亡的情况下,衰老的大脑具有从某些类型的损伤中反弹的隐藏能力。
我们的发现也对急性损伤以及不仅仅是逐渐退化具有意义。在对患有脑震荡或创伤性脑损伤的啮齿动物使用 IPW 治疗后,这种药物减轻了安慰剂治疗的动物中出现的炎症、癫痫发作和认知能力下降。
修复损伤
世界人口正在老龄化,痴呆症和阿尔茨海默病患者的数量正在上升。神经科学家对从年轻、健康的大脑到衰老、功能失调的大脑的转变的早期触发因素知之甚少。阿尔茨海默病和其他衰老神经系统疾病是复杂的。大脑处理异常蛋白质的方式存在缺陷可能在这些疾病的开始中发挥作用,或者触发因素可能是神经元之间电信号的损害,仅举两个可能性。
现在,泄漏的 BBB 也必须被认为是强有力的竞争者,尽管它可能不是唯一的原因或唯一的治疗途径。这种屏障破裂理论提供了一个非常直观和直接的新模型来理解为什么大脑会随着年龄的增长而衰退。这是一个让我们感到乐观的模型:我们的工作结果强烈暗示,衰老的大脑保留了重塑和恢复自身的能力,这种能力可能受到持续泄漏和我们追踪到的随之而来的事件链的长期抑制,但并非不可逆转地丧失。
我们的下一步是寻找减少屏障泄漏的策略和疗法。过去,针对屏障的药物研究侧重于提高通透性的方法,而不是限制通透性的方法,以便让更多药物穿过屏障以治疗脑肿瘤或感染。我们的结果表明,现在是时候扭转问题了:我们能否想出阻止保护罩退化、阻止有害物质穿过屏障的方法,或者至少在分子多米诺骨牌倒塌时中断它们?如果我们能弄清楚这些事情,就有机会为很多人做好事。