早在最早的动物在远古地球被水覆盖的表面游动之前,生命史上最重要的相遇之一就发生了。一种原始细菌被我们最古老的祖先——一个单独的、自由漂浮的细胞吞噬。两者融合形成了一种互惠互利的关系,这种关系已经持续了十亿多年,后者提供了一个安全、舒适的家,前者变成了一个动力源,为维持生命所必需的过程提供能量。
这是迄今为止关于被称为线粒体的细胞成分或细胞器如何形成的最好假设。今天,数万亿个这样的细菌后代生活在我们体内,产生 ATP,这种分子能量来源维持着我们的细胞。尽管线粒体与人体机制密不可分地结合在一起,但它们也保留了其细菌过去的残余物,例如它们自己的 DNA 组。
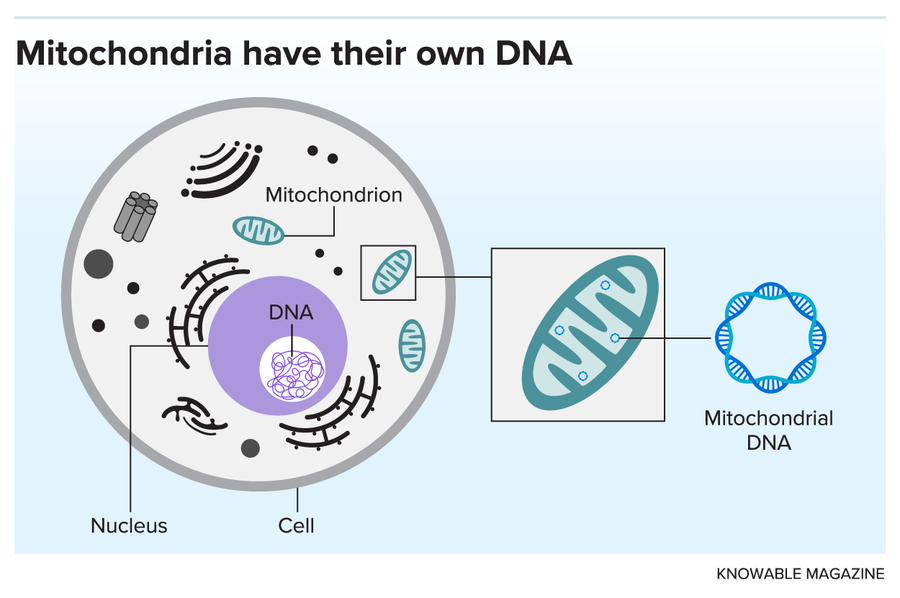
构成人类基因组的 DNA 包含在我们细胞的细胞核中。但线粒体拥有自己的环状 DNA 组,这很可能是它们古代细菌过去的残余物。
支持科学新闻事业
如果您喜欢这篇文章,请考虑通过以下方式支持我们屡获殊荣的新闻事业 订阅。通过购买订阅,您正在帮助确保未来能够继续讲述关于塑造我们当今世界的发现和思想的具有影响力的故事。
这些特征使线粒体既成为我们细胞的关键要素,又成为潜在问题的来源。与构成人类基因组的细胞核内的 DNA 一样,线粒体 DNA 也可能携带突变。年龄、压力和其他因素可能会扰乱线粒体的许多功能。最重要的是,线粒体损伤会释放分子,由于它们与细菌产生的分子相似,可能会被我们的免疫系统误认为是外来入侵者,从而引发针对我们自身细胞的有害炎症反应。
似乎有一个器官特别容易受到线粒体损伤:我们能量需求旺盛的大脑。“细胞的能量需求越高,它们拥有的线粒体就越多,线粒体健康就越关键——因此出现问题的可能性就越大,”美国国家神经疾病与卒中研究所 (NINDS) 研究神经退行性疾病的博士后研究员安德鲁·默尔曼 (Andrew Moehlman) 说。据估计,每个神经元最多可以有 200 万个线粒体。
一小部分但数量不断增长的科学家现在正在将注意力转向线粒体对大脑健康的贡献。对人类和实验动物的研究——尽管其中大部分仍处于初步阶段——表明,这些细胞器可能是几乎所有类型脑部疾病的关键因素,包括神经发育障碍(如自闭症)、精神疾病(如抑郁症和精神分裂症)以及神经退行性疾病(如帕金森病)。它们甚至可能处于研究脑部疾病的研究人员长期存在的谜团的核心:遗传易感性和环境影响如何相互作用,使人们面临患上这些疾病的风险。
动力源的问题
在 20 世纪 60 年代,研究人员发现线粒体拥有一组独特的遗传物质。调查显示,线粒体 DNA 像细菌的 DNA 一样,形成一个环状链,仅编码 37 个基因——仅占人类基因组中数万个基因的一小部分。
不久之后,在 20 世纪 70 年代,耶鲁大学的一名博士生道格拉斯·华莱士 (Douglas Wallace) 对线粒体 DNA 产生了兴趣。华莱士推断,由于线粒体是人体能量的主要生产者,因此其 DNA 的突变会导致疾病。“当时没有人认为这是合理的,”他说。直到 1988 年,华莱士和他的同事首次建立了线粒体 DNA 突变与人类疾病之间的联系——莱伯氏遗传性视神经病变,一种导致突发性失明的疾病——医学研究人员才开始认真对待这个想法,华莱士回忆道。
此后,研究人员已将数十种疾病与线粒体 DNA 和与线粒体功能相关的核 DNA 的改变联系起来——有趣的是,其中大多数疾病要么是神经系统的,要么对大脑有一定影响。华莱士现在是费城儿童医院线粒体和表观基因组医学中心主任,他有一个简单的解释:尽管大脑仅占人体重量的 2%,但它却消耗了大约五分之一的身体能量。华莱士说,就像高能电器在城市停电期间电压水平下降时会受到不成比例的影响一样,即使线粒体功能略有下降,也可能对大脑产生巨大影响。
华莱士对线粒体如何可能导致自闭症谱系障碍特别感兴趣。几个研究小组的研究表明,线粒体疾病,即由细胞器缺陷引起的一系列症状,在自闭症患者(5%)中比一般人群(约 0.01%)更为普遍。另有 30% 到 50% 的自闭症儿童表现出线粒体功能障碍的迹象,例如细胞呼吸产生的某些副产物水平异常,而细胞呼吸是 ATP 的产生过程。
在一些自闭症患者中,科学家已经发现了线粒体 DNA 或人类基因组中已知影响线粒体功能的大约一千个基因中的一些基因的遗传差异。还需要做更多的工作来确定这些遗传变异是否真正导致或促成了自闭症,但最近一项对小鼠的研究暗示可能存在联系。华莱士及其同事今年早些时候在PNAS 上报告说,线粒体 DNA 中的特定突变可能导致小鼠出现类似自闭症的特征,包括社交互动受损、胆怯和强迫行为。
遗传改变并不是线粒体可能导致自闭症的唯一途径。某些环境因素,如有毒污染物,也与患上这种疾病的较高风险有关。亚利桑那州凤凰城儿童医院的儿科神经学家和自闭症研究员理查德·弗莱 (Richard Frye) 及其同事发现,这些因素也可能扰乱自闭症患者线粒体的健康。在一项研究中,他们发现自闭症儿童出生前接触的空气污染量会改变其线粒体产生 ATP 的速率。在另一项研究中,研究人员发现早期接触营养金属(如锌)以及有毒金属(如铅)与这些细胞器在日后患有自闭症的人体内的功能之间存在相关性。弗莱说,总而言之,这些发现表明,线粒体可能是自闭症与导致该疾病的环境影响之间缺失的环节。
“现在就对很多事情做出任何确定的结论还为时过早,但看起来很多自闭症儿童的线粒体都受到了破坏,”弗莱说。“环境暴露,尤其是早期暴露,可能会对线粒体进行编程,使其具有不同类型的呼吸生理学特征。”
研究人员还在精神分裂症和抑郁症患者中发现了线粒体功能障碍的迹象,例如它们代谢糖产生能量的方式紊乱。此外,研究还表明,线粒体可能对许多精神疾病的风险因素敏感:早年生活的心理压力。例如,童年时期经历过创伤事件的人,每个细胞似乎拥有更多的线粒体基因组。布朗大学的生物精神病学研究员特蕾莎·丹尼尔斯 (Teresa Daniels) 说,线粒体 DNA 的这种增加(可能表明新线粒体的形成)可能是为了补偿细胞器中的问题,她正在努力解决这个问题。丹尼尔斯是 2020 年发表在临床心理学年度评论 上的一篇论文的合著者,该论文讨论了线粒体在精神疾病中的作用。
托莱多大学研究脑部疾病的医生科学家罗伯特·麦卡勒姆斯密斯 (Robert McCullumsmith) 说,尽管线粒体功能障碍似乎出现在多种脑部疾病中,但尚不清楚这些细胞器的缺陷是这些疾病的主要原因还是次要影响,但他并未参与线粒体方面的研究。“这有点像先有鸡还是先有蛋的问题,”他说。然而,麦卡勒姆斯密斯补充说,研究线粒体在这些疾病中的作用非常重要,他看到了有希望的证据表明,即使不能治愈这些疾病,靶向线粒体的疗法最终也可能使患者受益。
当朋友变成敌人
当线粒体受损或功能失调时,一个后果仅仅是 ATP 减少,因此大脑正常运作的能量也减少。但线粒体可能导致脑部疾病的另一种方式源于它们的祖先历史。
作为细菌的后代,线粒体具有 DNA 和其他成分,当细胞受伤或受到压力时,这些成分会被释放出来,并被我们的免疫系统误认为是外来威胁。2010 年,哈佛大学的研究人员报告称,严重身体损伤(如车祸造成的骨折或出血)患者的血液中会迅速释放线粒体 DNA。反过来,这会吸引免疫细胞并引发严重的炎症反应,类似于败血症——一种危及生命的疾病,免疫系统会攻击人体自身的组织。
几年后,当时在耶鲁大学做博士后的 A·菲利普·韦斯特 (A. Phillip West) 及其同事表明,即使在没有如此严重的损伤的情况下,例如当细胞器缺乏关键蛋白质时,DNA 也可能从线粒体中泄漏出来并激活免疫系统。
越来越多的研究表明,线粒体 DNA 释放引起的炎症可能导致神经退行性疾病(如帕金森病、阿尔茨海默病和肌萎缩侧索硬化症 (ALS))中发现的损伤。在不同的研究方向中,科学家已将这些疾病与炎症以及无法正确清除细胞中缺陷线粒体联系起来。线粒体引发的炎症可能是两者之间缺失的环节。
例如,与某些形式的遗传性帕金森病相关的两个基因——PINK1 和 PRKN 中的突变——会导致受损线粒体被分解和从细胞中清除的过程出现问题。2019 年,NINDS 的理查德·尤尔 (Richard Youle) 领导的一个小组证明,在 PINK1 和 PRKN 突变的小鼠中,诱导线粒体损伤(通过精疲力竭的运动或改变线粒体 DNA)会激活炎症分子。这些动物的大脑中也失去了产生多巴胺的神经元,并出现运动问题——这是帕金森病的标志。然而,当研究人员对经过基因改造而缺乏重要炎症分子的小鼠重复实验时,这些影响并未发生。总之,这些发现表明,在基因上易患帕金森病的动物中,压力或线粒体 DNA 中的故障都可能引发促进该疾病的炎症。
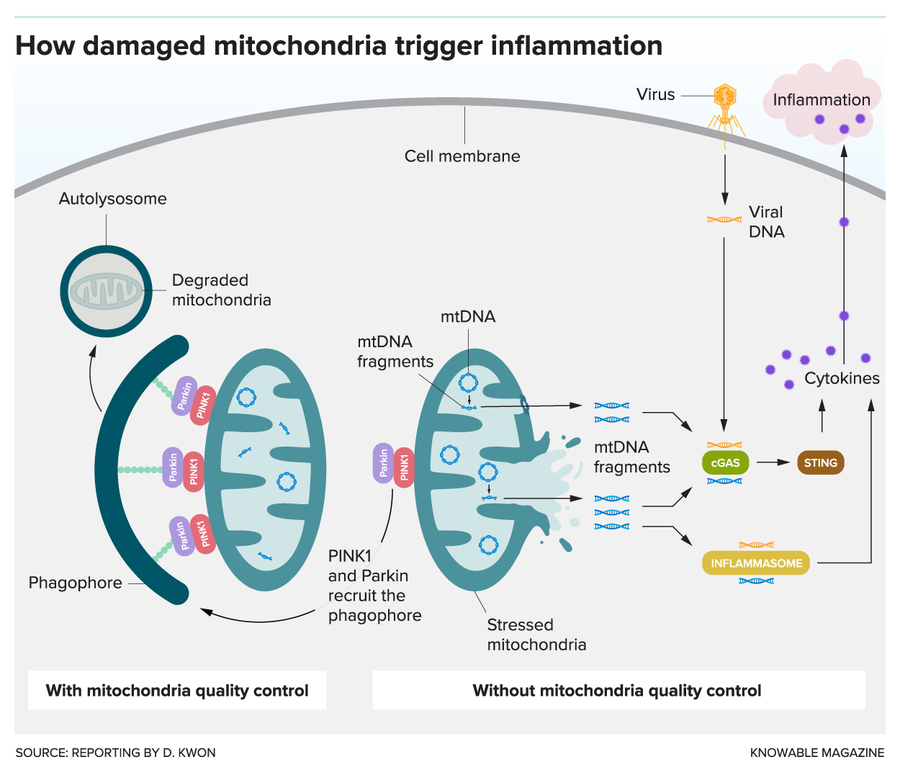
细胞具有多种质量控制机制来去除功能失调的线粒体。一种重要的机制涉及 Parkin 和 PINK1 蛋白。当线粒体受损时,PINK1 和 Parkin 会募集吞噬泡,吞噬泡会吞噬细胞器并开始降解过程。当这种质量控制系统失效时,受损的线粒体 DNA (mtDNA) 可能会从线粒体中逃逸。(这种情况是如何发生的仍然是一个悬而未决的问题,但它可能通过特殊孔隙或线粒体膜的破裂而逸出)。一旦释放,mtDNA 片段可以激活 cGas-STING 或炎症小体等分子,这两者都可以感知来自病毒和其他入侵者的外来 DNA。反过来,这可以增加细胞因子的产生并引起炎症。
虽然还需要做更多的工作来确定人类是否也会发生相同的过程,但“有很多证据表明,未能维持健康的线粒体是导致帕金森病症状发展的早期病理事件之一,”默尔曼说,他与尤尔合著了 2020 年发表在细胞与发育生物学年度评论 上的一篇论文,该论文讨论了线粒体问题如何可能导致神经退行性疾病。
随着线粒体 DNA 泄漏是不祥之兆的证据越来越多,一些研究人员正在将注意力转向原因。现在是德克萨斯农工大学免疫生物学家的韦斯特说,可能有很多过程在起作用。他说,一种情况是,细胞器随着时间的推移不断释放低水平的 DNA——当遗传或环境因素加剧这种情况时,这种积累可能会达到疾病发生的阈值。
心理压力可能是其中一个因素。在 2019 年的一项研究中,哥伦比亚大学的线粒体心理生物学家马丁·皮卡德 (Martin Picard) 及其同事报告说,在简短的公开演讲任务中,参与者被要求为自己辩解,反对一项所谓的过错,之后血液中游离的线粒体 DNA 水平升高,表明线粒体已经释放了它们的遗传物质。
韦斯特说,这种线粒体损伤和 DNA 释放可能会导致人类疾病,即使在没有感染的情况下,炎症也似乎在其中发挥作用,例如癌症、自身免疫性疾病和神经退行性疾病。
他和其他人也怀疑线粒体引起的炎症可能是衰老本身的关键驱动因素。在最近的一项研究中,韦斯特的团队证明,经过基因改造使其线粒体 DNA 不稳定的小鼠衰老得更快,出现了脱发和骨质流失等问题,并且过早死亡。消除由线粒体 DNA 激活的免疫系统元素逆转了这一过程,将动物的寿命延长了约 40 天。(这些结果在 bioRxiv 上发表,尚未经过同行评审。)韦斯特说,如果未来的研究证实这一点,它将提供证据表明,至少在这些小鼠中,衰老部分是由线粒体损伤驱动的。
多用途线粒体
线粒体还具有其他功能,有助于维持健康的大脑功能——或者在功能失调时引起问题。例如,线粒体有助于控制细胞代谢的潜在有毒副产物(称为活性氧)的平衡,以及皮质醇等应激激素的合成。线粒体也具有高度动态性——通过信号分子和物理连接相互通信。它们不断经历裂变(一个大的线粒体分裂成两个小的线粒体)或融合(当它们结合时)。研究人员才刚刚开始意识到,这些持续的相互作用也可能以各种方式影响大脑功能和行为。
瑞士联邦理工学院的行为神经科学家卡门·桑迪 (Carmen Sandi) 及其研究小组检查了具有高焦虑样行为的小鼠的线粒体,例如不太愿意在开放区域度过时间。他们发现,在这些动物中,与表现出较低焦虑水平的动物相比,伏隔核(一个参与奖励处理的大脑区域)神经元中的线粒体在产生 ATP 方面不太擅长。高焦虑动物也表现出较低水平的融合酶——这种酶使线粒体能够结合并混合其内容物,以便在需要时相互支持。研究人员发现,提高这种蛋白质的水平不仅恢复了线粒体功能,还减少了焦虑行为。
诸如此类的发现让科学家有理由希望,他们有一天能够开发出针对这些细胞器的脑部疾病治疗方法。例如,弗莱最近开始了一项临床试验,以调查营养补充剂是否可以逆转他的团队在自闭症儿童身上发现的线粒体异常。华莱士补充说,研究人员已经知道许多潜在的治疗方法,可以帮助增强线粒体的功能——从药物到行为干预,例如运动。
测试此类干预措施需要时间。目前,科学家们正忙于解开线粒体在大脑中具有的多种功能。这项工作的大部分仍处于初步阶段,但来自包括神经科学、免疫学和心理学在内的各个学科的证据让科学家们对未来感到兴奋。桑迪说,关于线粒体的新发现还有很多空间。“我认为它们的作用远不止神经科学家过去认为的那样。”
10.1146/knowable-061621-1
本文最初发表于 Knowable Magazine,这是 Annual Reviews 的一项独立新闻事业。注册新闻通讯。