去年 12 月,一种名为 neratinib 的实验性药物的乳腺癌试验引起了业界的关注,但引起轰动的原因不仅仅是这种药物。
不寻常的是试验本身。该试验名为 I-SPY 2,它并行评估多种候选药物,而不是通常一次评估一种药物的做法。这种方法是改革药物审批这一耗时且成本高昂的过程的众多努力的一部分,该过程通常未能考虑到癌症生物学的复杂现实。
在 I-SPY 2 中,每种药物都在肿瘤具有特定分子特征的患者中进行筛选。该试验在积累数据的同时“学习”,因此,它不是随机地将新患者分配到治疗组或对照组,而是利用早期结果来调整招募。Neratinib 由位于加利福尼亚州洛杉矶的 Puma Biotechnology 公司生产,只是正在测试的五种靶向化合物之一,所有化合物都旨在选择性地阻断参与肿瘤生长的信号通路。
支持科学新闻报道
如果您喜欢这篇文章,请考虑通过以下方式支持我们屡获殊荣的新闻报道: 订阅。通过购买订阅,您将有助于确保有关塑造我们当今世界的发现和思想的具有影响力的故事的未来。
药物审批的标准途径包括证明 I 期试验的安全性、II 期试验的临床效果,然后进行 III 期随机对照试验 (RCT),以确认实验性治疗是否比目前的护理标准提供具有统计学意义的改善。RCT 促成了有价值的治疗方法的发现,这些方法既能延长生存时间,又能提高生活质量。“我们早期确实取得了一些杰出的成功——比如儿童白血病,我们看到各种药物的少量改进不断累积,直到这种疾病变成通常可以治愈的疾病,”伦敦英国医学研究委员会临床试验部门的医学肿瘤学家理查德·卡普兰说。
此后,抗击癌症的进展有所放缓,但许多肿瘤学家充满希望,认为它有望再次加速。由于对遗传学和细胞生物学的更深入了解,细胞毒性化疗这种不加选择地靶向所有快速分裂细胞的钝器,现在正在被专门为具有特定分子特征或生物标志物的肿瘤而开发的药物所补充。但临床研究设计尚未跟上步伐。许多 RCT 仍然倾向于采取广阔的视角,对两个大致相同的患者组中的药物性能进行相对简单的比较。但它们未能考虑个体遗传学,这意味着它们可能会产生误导性的结果。
以吉非替尼的故事为例,这是一种由伦敦阿斯利康公司开发的靶向药物,以易瑞沙为商品名上市。在一些非小细胞肺癌 (NSCLC) 患者中显示出早期希望后,该药物在 2005 年的 III 期试验中失败(参考文献 1)。该试验的近 1,700 名患者并未根据其肿瘤突变谱进行选择。“该公司采取了尝试治疗所有 NSCLC 的策略,”德克萨斯州休斯顿 MD 安德森癌症中心的生物统计学家唐纳德·贝里说。“它希望这个小亚群的获益能够推动事情的发展。”该试验的不良结果导致美国食品和药物管理局 (FDA) 对可以开具该药物处方的人员施加了严格限制。后来的分析
2 然而,揭示了该药物对特定亚群患者有效,吉非替尼现在在欧洲可供具有适当突变的患者使用。
批评者指出吉非替尼的故事是新药与旧试验设计之间发生冲突的例证。他们断言,传统的随机试验成本过高,延误了良好疗法的识别,并掩盖了仅对一部分患者有效的良好药物的益处。
张开双臂
然而,在某种程度上,吉非替尼是更快地将药物提供给患者的进展的一个例子。它是通过 FDA 的加速审批计划获得批准使用的多种肿瘤药物之一。该计划允许药物在 II 期研究中显示出临床效果的有力证据后即可上市,只要随后进行 III 期试验以确认该效果即可。(这就是吉非替尼失败并受到严格限制的地方)。
由于管道中有众多候选药物,制药公司必须就如何投资其资源做出艰难的决定。当并行进行许多单独的试验时,它们会争夺有限的患者群体。一项研究
3 表明,要填补 2011 年美国所有胰腺癌试验,需要 83% 的可手术治疗肿瘤患者参与。然而,根据美国癌症协会的数据,只有约 5% 的患者自愿参加试验。
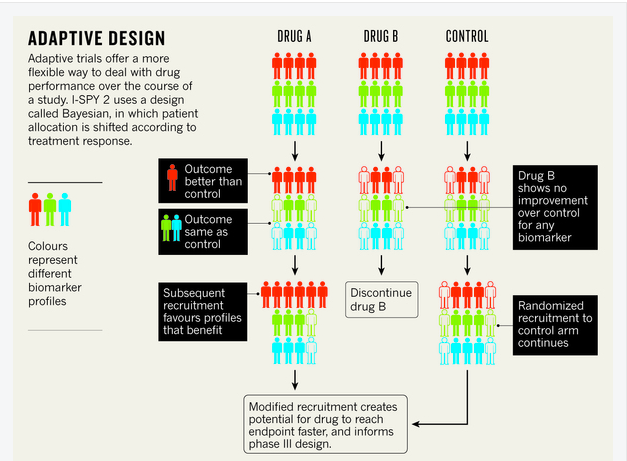
多臂适应性试验(如 I-SPY 2 和 FOCUS4,一项于 1 月开始招募的结直肠癌试验)提供了一种解决公司资源和可用患者数量限制的方法。这些 II 期试验同时研究多种标志物和候选药物,通过扩大有希望的治疗方法的研究并停止那些未显示任何效果的治疗方法来响应结果(见下文)。
I-SPY 2 根据乳腺癌患者肿瘤的分子特征将其分为十个亚组。然后,每个亚组在治疗组和对照组之间进行划分。将每种药物的反应与单个对照组进行比较。未来的招募并非严格随机,而是根据输入的试验数据进行。这样,早期有希望的药物-生物标志物组合将分配给更多具有相同生物标志物特征的患者。
“这关系到随着时间的推移更新知识,并根据这些知识修改你的行动,”贝里说,他与加利福尼亚大学旧金山分校的乳腺癌专家劳拉·埃瑟曼共同组织了该试验。I-SPY 2 有第二位毕业生进入 III 期试验——来自伊利诺伊州北芝加哥艾伯维公司的药物 veliparib。其他五种化合物仍在测试中。
FOCUS4 正在招募患者进入四个治疗组。与 I-SPY 2 不同,患者被分配到与其生物标志物特征被认为匹配的治疗方法。每个治疗组都有自己的对照组,由具有相同生物标志物的患者组成。在其生物标志物匹配组中表现良好的药物也将给予肿瘤缺乏该标志物的个体,以测试更广泛的效果。一个单独的仅化疗组将治疗因任何原因无法参加其他组的患者,以及那些对试验中的治疗没有反应但可能从未来靶向其肿瘤亚型的药物中获益的患者。
与通常的做法不同,I-SPY 2 侧重于初始治疗,而不是将自身限制于晚期、转移性或耐药性疾病预后不良的患者。“在癌症中,总是首先关注转移性疾病,如果没有任何效果,你就不会继续,”贝里说。“我们必须更早地关注。”I-SPY 2 中的女性接受“新辅助”治疗,旨在在切除肿瘤之前缩小肿瘤。试验设计者倾向于避开可能已经可以通过标准治疗治愈的早期患者,但早期肿瘤通常突变较少且更同质,因此可能更容易靶向。
加利福尼亚大学圣地亚哥分校个性化癌症治疗中心主任 Razelle Kurzrock 说,这种早期阶段的测试已导致慢性粒细胞白血病 (CML) 的预后得到改善。CML 已经有一种有效的靶向药物:伊马替尼,诺华公司以格列卫或格列维克为商品名销售。当医生仅将这种药物作为最后手段使用时,伊马替尼的回报有限。但 Kurzrock 说,当医生开始在诊断时就给患者服用该药时,疗效的提高是巨大的。“缓解率不再仅仅是 10%,”她说。“接近 100%。”
令人鼓舞的是,FDA 在 2012 年年中宣布,它将考虑加速批准可以消除无需手术即可检测到的肿瘤组织的乳腺癌药物
4,部分依据来自 I-SPY 2 等试验的数据。2013 年 9 月,该机构首次批准了帕妥珠单抗的新辅助用途,罗氏公司以帕捷特为商品名销售。
这些试验设计通过为几乎所有来者创建治疗组,而不是简单地拒绝不符合单一生物标志物标准的患者,从而为患者参与提供了更多机会。此外,与为每种治疗方法设置一个对照组的费用相比,I-SPY 2 的唯一对照组节省了大量费用。FOCUS4 和 I-SPY 2 还通过寻求比临床试验中通常寻求的收益更大的药物收益来提供更大的成本削减潜力——通常,治疗药物的无肿瘤进展生存期是对照组的两倍。这减少了获得可靠 III 期数据所需的患者数量,并确保只有高性能的候选药物才能进入下一阶段。“如果一种药物在期中分析期间未能达到其预先设定的结果,我们将关闭该组,”卡普兰说。
从 I-SPY 2 成功毕业需要预测一种药物有 85% 的机会在 300 名患者的 III 期试验中获得成功,如果参与公司选择继续,FOCUS4 中的治疗组可以无缝过渡到 III 期。这也是肺癌主协议的一个特点,该协议是由华盛顿特区癌症研究倡导组织之友开发的鳞状细胞肺癌适应性试验。该试验预计很快开始招募。
重新定义疾病
随着基因组研究开始提供关于不同癌症突变谱的更多信息,并且随着更多生物标志物的出现,研究人员正在重新评估癌症分类(参见“第二次机会”)。例如,与具有不同突变的两种乳腺癌相比,与乳腺癌共享突变的结直肠癌可能具有更多共同点。如果事实证明如此,那么这些应该成为指导药物测试的相似之处。
Kurzrock 是许多赞成分子谱分析而非基于组织的定义的人之一。“如果你有一种靶向特定异常的药物,你就会想关注这种异常——而不是你是否正在处理乳腺癌,”她说。支持这种模型的证据正在增加。例如,尽管 FDA 已批准克唑替尼(辉瑞公司以赛可瑞为商品名销售)用于 NSCLC,但临床研究表明,该药物也可能对具有相同突变的侵袭性脑肿瘤儿童有效
5.
此类批准现在必须通过针对不同疾病的试验逐步获得。为了加快速度,几家公司正在开展“篮子”试验,在具有常见基因破坏的多种癌症中测试治疗方法。葛兰素史克公司正在九种癌症(包括脑癌、甲状腺癌和肠癌)中测试两种黑色素瘤药物达拉非尼和曲美替尼,这些癌症都具有 BRAF 基因突变,这可能使它们容易受到这些药物的影响。该公司肿瘤研究和开发高级副总裁拉斐尔·阿马多认为,这种方法为患有罕见癌症的患者带来了希望,否则他们可能会被遗漏。通过进行从肿瘤组中获取数据的分析,即使是小规模的阳性结果也可能在统计学上变得有意义。阿马多说,因此,“我们不必在这些超罕见人群中进行非常大规模的随机试验”。
美国国家癌症研究所正在通过其“分子分析指导治疗选择”计划探索这种方法,该计划使用靶向基因测序将各种药物与患有实体瘤或淋巴瘤且疾病在现有治疗方法上已进展的人员进行匹配。“我们一开始将有大约 20 个组,目标是您可能在癌症中发现的常见可疑突变,”该研究所癌症诊断计划副主任芭芭拉·康利说。“如果我们能够让 35% 或更多的跨肿瘤类型的患者存活六个月或更长时间,那将是一个有趣的信号。”这些本质上是寻找可能证明转向 III 期合理的迹象的 II 期试验,但监管机构表示,他们愿意正式承认跨肿瘤疗效的有力证据。“FDA 可以根据分子定义的群体而不是特定于疾病部位的适应症批准药物,”该机构肿瘤和血液学产品办公室主任理查德·帕兹杜尔说。
然而,额外的复杂性可能会使这种广泛的生物标志物知情的研究变得更加复杂。例如,在某些黑色素瘤中有效的 BRAF 抑制剂在具有相同突变的结直肠肿瘤中无效。但 Kurzrock 认为,普遍有效性是不切实际的期望。“如果你看看为肺癌批准的药物,缓解率通常在 15-20% 的患者范围内,”她说。“我们不能期望根据基因组分类接受治疗的 100% 的患者都能做出反应。”
事实上,肿瘤通常包含可能驱动耐药性的多种突变——靶向药物的常见障碍表明,每位患者的癌症可能需要专门的药物组合。“我们将需要测试一种新的个性化患者和以患者为中心的护理策略,”Kurzrock 说,“而不仅仅是测试一种药物或药物组合的旧方法。”
这种复杂性意味着研究人员和肿瘤学家将面临陡峭的学习曲线。贝里认为,肿瘤学最终将经历一场广泛的转型——将药物测试视为洞察疾病的机会,而不仅仅是验证现有假设。“未来实际上是将临床实践和临床试验相结合,并在试验中同时具有学习和确认的概念,”他说。“这将意味着完全不同的监管视角和公司完全不同的商业模式。”
本文经许可转载,最初于 2014 年 5 月 28 日首次发表。
