我热爱黄石国家公园。我曾到访远东的日本,追寻罗马人的足迹,仰望比萨斜塔,远距离和近距离地体验火山,并触摸冰川。然而,我一次又一次地回到黄石公园,凝视瀑布和湖泊,尤其着迷于公园里许多温泉、间歇泉、泥浆池和喷气孔的鲜艳彩虹色。
这些色彩吸引着我。它们是由数百万个紧密排列的细菌细胞组成的,这些细胞被包裹在粘液基质中。虽然单个细菌肉眼不可见,但在这层粘液中,它们形成了容易看到的群落,被称为微生物垫或“生物膜”。通过显微镜观察,这些膜显示出显著的三维结构,微生物相互粘连,形成多层细丝、蜿蜒的通道和类似微型塔楼的结构。在我看来,它们就像粘液城市,一个脉动的都市,有街区和摩天大楼,街道比东京或纽约的主要大道还要繁忙。你也见过生物膜:它们在你家排水沟里形成又厚又粘的堆积物,以及浴缸周围顽固的污垢圈。
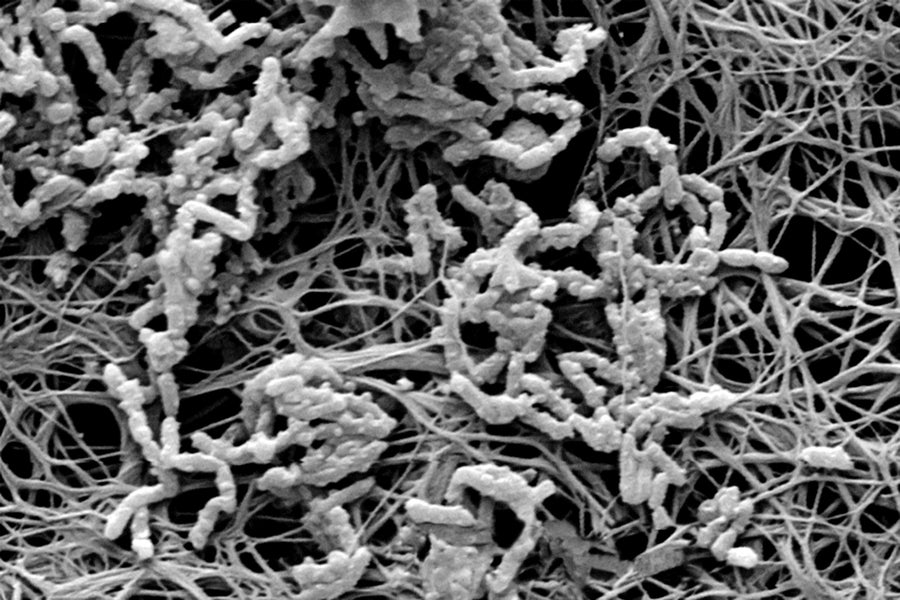
微观威胁:医用导管内部覆盖着细菌生物膜(显微照片),可能导致血液感染。图片来源:Getty Images
支持科学新闻报道
如果您喜欢这篇文章,请考虑订阅以支持我们屡获殊荣的新闻报道。 订阅。通过购买订阅,您将有助于确保未来继续有关于塑造我们当今世界的发现和想法的具有影响力的报道。
虽然这种堆积物令人讨厌,但在医学上,生物膜对我们的健康构成严重威胁。当细菌成功在人体内形成生物膜时,它们会抵抗抗生素,并可能成为手术部位、肺部和泌尿道慢性感染的罪魁祸首。生物膜可以定植于医疗设备和植入物,如导管、人工关节和心脏瓣膜。总体而言,65%的医院获得性感染是由以生物膜形式生长的细菌引起的。仅在美国的医院,每年就有170万例此类感染,并有9.9万例相关死亡,造成的危害巨大。据认为,生物膜每年夺去的生命与癌症一样多——这确实是一个令人沮丧的统计数字。
为什么生物膜在医学上如此棘手?传统的治疗方法旨在治疗单个细菌引起的感染,但已被证明在治疗许多(如果不是大多数)生物膜感染方面是不够的。这是因为以生物膜形式生长的细菌不仅具有逃避宿主防御和免疫反应的极端能力,而且还表现出对抗生素的非凡耐受性。生物膜的这种韧性与细菌获得耐药性或变成我们经常听到的“超级细菌”无关。相反,正是三维结构使生物膜如此顽强且难以消除。在生物膜内部,细菌相互交流、合作和交换物质,不仅组织它们的结构特征,还制造蛋白质和其他物质来相互支持和保护。
早期有线索表明,生物膜内的细菌与单个细胞变得根本不同。1998年,研究人员乔治·A·奥图尔和罗伯托·科尔特证明,土壤细菌荧光假单胞菌形成生物膜需要合成新的蛋白质以及24个基因的存在。大多数基因的功能尚不清楚,尽管有些基因编码用于表面附着的蛋白质,如粘附素。这些神秘基因表明,成为一个附着细胞意味着承担一种新的细菌生理学。然后,在2002年,我和我的同事证明,细菌不仅在表面接触时发生变化,而且随着生物膜从几个附着细胞发展成三维群落,它们会不断转变和适应,在每个阶段产生不同的蛋白质组。进一步的研究表明,这些蛋白质能够按设定的顺序实现从一个生物膜阶段到下一个阶段的转变。
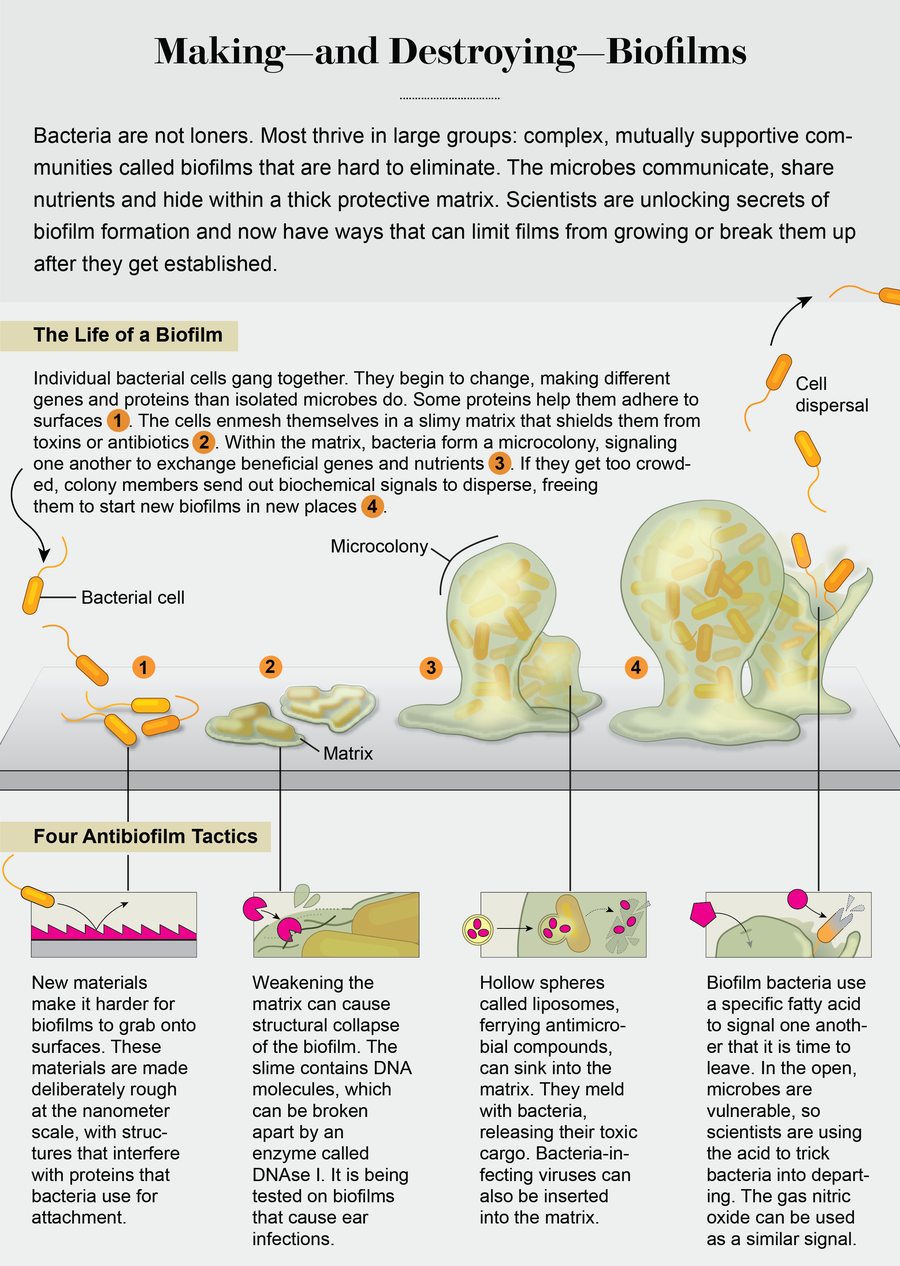
这些发现表明,生物膜就像城市一样,一块砖一块砖地建造起来,它们的建造遵循总体规划,一次一个建造阶段和一个街区。了解生物膜是如何建造的意味着我们已经开始了解如何干预总体规划。在实验室中,通过添加抑制或增强其中一些蛋白质的化学物质,我们可以将生物膜阻止在特定的发育阶段,甚至可以重塑它们,使它们恢复到早期阶段。一些策略正在走向临床应用。
不健康的附着
首先防止细菌附着是一个好的起点。这项研究的大部分都集中在开发能够接触杀死细菌的表面材料或涂层。这可以通过使用表面涂层或浸渍表面来实现,这些表面能够以高浓度局部递送抗菌剂。几种这样的表面在医院中已经很常见,包括浸渍抗生素的缝线和含有浸渍抗生素珠子的骨水泥,以及涂有胶体银或银纳米颗粒的导管、伤口敷料和气管插管。银离子接触杀死细菌。杀灭机制尚未完全了解,但我们确实知道银离子会造成氧化损伤(其中氧原子从微生物的重要生物分子中夺走电子),从而导致细菌细胞死亡。除了银,金属氧化物和金属盐——铁、汞、碲、锌、钛——也在为临床目的进行测试。
然而,表面涂层和浸渍表面有一个致命弱点,因为涂层中的抗菌物质最终会耗尽。再加上人们对过度使用旨在杀死细菌的药物和化合物(包括银)以及随之而来的细菌耐药性出现的担忧,这促使人们开发新的表面材料,以更机械的方式控制附着。这些表面的灵感来自大自然,模仿鲨鱼皮的纹理,或荷叶中发现的自清洁纹理,或贻贝用于排斥细菌的化学功能。仿生表面不一定能阻止细菌附着,而是干扰它们用作附着平台的蛋白质。这个过程通过在微观层面改变表面粗糙度来起作用。这可以通过添加纳米结构来实现,例如由聚合物制成的刷子、晶体和小管,这些聚合物被水分子吸引,例如聚乙二醇(PEG,灵感来自贻贝),以及被称为两性离子聚合物的化合物,这些化合物的灵感来自血细胞的防污特性。
图片来源:Jen Christiansen
纳米结构可以以不同的距离排列,以不同程度地减少细菌附着。其中一些仿生表面现在已在临床上广泛使用。其他一些仍处于概念验证阶段,仍有制造限制和毒性问题等障碍需要克服。
攻击基质
尽管抗菌生物膜表面对于医疗植入物来说很有前景,但治疗克服了这种抗附着策略并在危险场所(在没有人造表面的情况下)形成的生物膜(如伤口或肺部中的生物膜)需要非常不同的策略。在这种情况下,包围生物膜的粘液基质成为目标。这种基质由称为多糖的长链糖分子、蛋白质和DNA组成,以多种方式帮助微生物片层。首先,基质充当保护层。它阻止或限制一些抗生素或被称为抗体的免疫系统标记物到达生物膜结构内的细菌。此外,基质充当结构框架,将细菌群落粘合在一起并粘附到表面。因此,去除这个框架可能导致结构完整性丧失和随后的崩溃,因为大的细菌团伙分解成较小的细胞簇或单个细胞。当这种情况发生时,被释放的细菌细胞再次变得容易受到药物和免疫系统的攻击。
靶向结构框架的缺点是生物膜基质的组成,更具体地说,基质中存在的蛋白质和多糖的类型,在不同细菌之间差异很大,每种类型都需要特定的降解酶。因此,旨在降解蛋白质和多糖的治疗方法需要根据形成生物膜的细菌类型进行定制。德克萨斯理工大学的肯德拉·伦巴赫和同事最近的发现表明,使用糖苷水解酶可能克服这个障碍,糖苷水解酶靶向多糖中存在的常见的高度保守的糖苷键。该团队证明,糖苷水解酶有效地破坏了金黄色葡萄球菌和铜绿假单胞菌的单培养和共培养生物膜,使崩解的生物膜细胞更容易受到传统抗菌药物的影响。动物的后续测试表明,这种疗法可能对具有不同基质组成的多种病原体有效。
另一个常见的基质成分可能是DNA,它似乎普遍存在于生物膜中。基质DNA容易被一种酶降解:DNA酶I。几项临床试验正专注于使用这种物质;它正在评估与抗生素联合用于治疗慢性中耳炎(中耳炎)和其他生物膜感染。DNA酶I已用于治疗早期肺部疾病的囊性纤维化患者,治疗与肺功能显著改善同时发生。(然而,在这种情况下,酶似乎正在降低痰液的粘性,从而增强肺部清除和抗生素疗效,而不是诱导生物膜的崩溃。)
发出撤退的信号
另一种不同性质的策略是从观察生物膜的发育方式中获得的。在细菌形成这些膜后,它们可以通过一个称为分散的过程来分解它们。当生物膜内部的资源(如营养物质)耗尽,或者当生物膜变得过于拥挤,或者当外部环境变得不稳定时,分散就会发生。分解可以帮助生物膜成员生存并在其他位置产生新的群落。
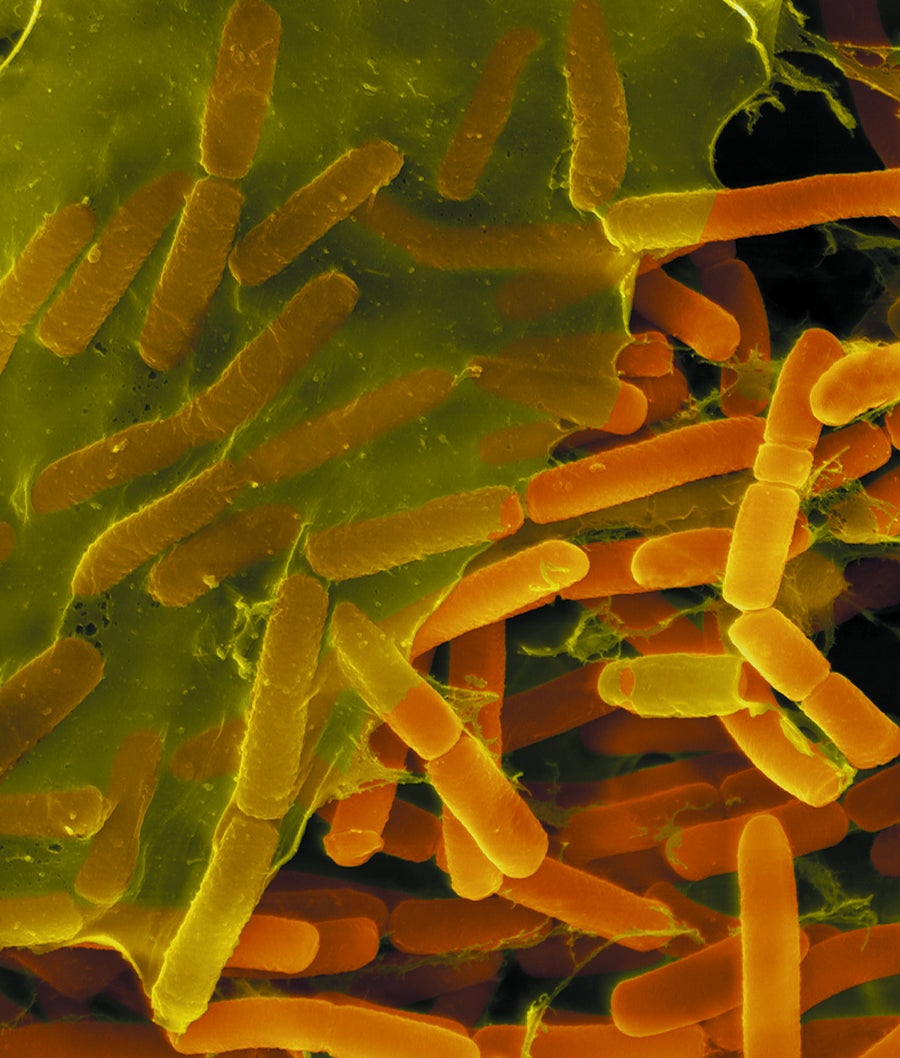
团结一致:芽孢杆菌(显微照片中的长方形)将自己覆盖在保护性基质中。图片来源:Dennis Kinkel Science Source
然而,离开生物膜的单个细胞正是我们擅长用药物治疗的那种未受保护的细菌。那么,我们如何引导成膜细菌改变其生活方式并逃离生物膜呢?研究人员已经确定了几种能够诱导这种转变的环境生长条件和化合物,包括暴露于重金属、营养物质和氧气的可获得性,以及信号分子(如一氧化氮和一种名为顺式-2-癸烯酸(顺式-DA))的存在。虽然这些分散触发因素非常多样化,但它们都具有一个共同点,即它们通过降低一种名为环二鸟苷酸的通用细胞内信号分子的水平来诱导分散。环二鸟苷酸的水平决定了细菌对表面的粘性,高水平与表面相关的生物膜生长和基质产生有关,而低水平与细菌作为单细胞生长有关。虽然对这些触发因素的反应而引起的环二鸟苷酸水平的变化与 80% 或更多的生物膜生物量被去除有关,但并非所有分散触发因素都适合在医疗环境中使用。
一氧化氮这种无色气体成为一个可行的候选者。我们自身的免疫系统利用一氧化氮来抵御细菌入侵者,它已经用于医学上以改善患有各种形式肺动脉高压(例如,慢性阻塞性肺疾病)的患者的氧合作用。实验室研究表明,一氧化氮介导了多种细菌的生物膜分散。单独使用一氧化氮平均可减少 63% 的生物膜。当与粘菌素等抗菌化合物结合使用时,一氧化氮能够在实验室实验中几乎完全去除生物膜。
尽管如此,尽管结果很有希望,但一氧化氮仍带来一些临床挑战。如果它扩散到身体的不同区域,可能会有毒,因此递送和限制在特定感染部位非常重要——而对于气体来说很难做到。为了更好地解决一些担忧,已经开发了各种制剂和装置。一个例子是头孢菌素-3'-二氮烯二醇盐。这种复方药物由抗生素(头孢菌素)和仅在接触含有称为β-内酰胺酶的酶的细菌细胞时才激活的一氧化氮产生物质组成。对青霉素和氨苄西林等抗生素具有抗性的细菌通常具有这种酶。
对铜绿假单胞菌(一种生物膜形成的模式细菌,也是大量医院获得性和慢性感染的病因)的研究表明,细菌有自己的方式告诉生物膜群落中的成员分散。这种细菌产生顺式-DA,使该生物能够向其群落成员发出信号,表明是时候离开了。顺式-DA发出分散信号的能力不仅限于铜绿假单胞菌生物膜。相反,人们发现顺式-DA也向由其他细菌以及酵母——而不是铜绿假单胞菌——形成的生物膜发出信号,使其分解。还有证据表明,其他细菌产生这种脂肪酸的不同版本,这意味着生物膜细菌可能使用特定的“方言”来告诉成员分散。尽管仍处于实验室测试阶段,但在未来治疗策略中,将此类信号和通讯分子与抗生素联合使用很可能具有代表性。
最近的一项研究进一步表明,丙酮酸(几种代谢途径中的关键中间体)的可用性可以充当浮游生活方式和生物膜生活方式之间的切换开关——高水平的丙酮酸似乎增强生物膜的形成,而丙酮酸的耗尽会诱导分散。在实验室实验中,研究人员使用酶来消耗丙酮酸,导致两种病原体铜绿假单胞菌和金黄色葡萄球菌分散。此外,当与抗菌化合物结合使用时,这种丙酮酸消耗条件增强了妥布霉素等抗生素杀死生物膜的潜力。当在感染铜绿假单胞菌的烧伤伤口上进行测试时,该联合策略也被发现对动物研究有效。事实上,人们发现联合治疗在根除烧伤伤口中存在的生物膜方面比更常用的抗菌霜磺胺嘧啶银更有效。
检测和感染
对抗生物膜的另一种策略是引起对其细菌成分的致命感染。像人一样,细菌也容易受到病毒的感染,在这些微生物的情况下,病毒被称为噬菌体。然而,虽然人不受噬菌体的影响,但细菌要么被永久感染,要么被杀死。自1996年早期研究噬菌体与生物膜相互作用以来,研究旨在鉴定能够杀死生物膜内细菌的噬菌体。此外,进入但不杀死细菌细胞的噬菌体仍然可以用作货运卡车,将抗生素或基质降解剂(如DNA酶I)递送到生物膜内的每个细菌。噬菌体疗法目前在美国境外用于治疗囊性纤维化患者的生物膜来源的肺部感染。
但与其他策略一样,这种疗法也带来自身的一系列问题。由于噬菌体以高特异性感染和杀死细菌,特定的噬菌体仅感染特定类型的细菌,这意味着它们不能用作广谱杀伤剂。而且,细菌可能对噬菌体攻击产生耐药性,就像它们对抗生素产生耐药性一样。
为了克服潜在的耐药性,研究人员开发了脂质体,或脂质包裹的囊泡,作为替代的货物载体。由于其尺寸小,被称为纳米颗粒,这些微型运输器背后的想法是将杀死生物膜细胞或破坏生物膜稳定性的化合物(如抗生素、抗菌化合物或基质降解酶)直接递送到它们需要的地方,进入生物膜或细菌本身。靶向机制基于脂质体中模仿细菌细胞膜上脂质的脂质。这种相似性使它们能够扩散到基质中。这就是该系统的优点所在。匹配的脂质使脂质体能够与细菌融合,从而使运输系统能够以类似于注射的方式将其货物直接倾倒入微生物中。这种策略的一个优点是靶向方法,因为抗菌和抗生物膜化合物仅递送到生物膜,而不递送到其他任何地方。脂质体已经是一种非常广泛使用的抗菌药物递送系统。
制胜组合
这里描述的策略仅仅触及了全球实验室中正在测试的大量策略的表面,其中一些策略处于早期开发阶段,另一些策略处于临床前阶段。但这些努力不仅表明了生物膜控制的重要性,也表明了真正控制粘液是多么具有挑战性,主要是因为并非所有生物膜都是相同的。每个细菌物种以略有不同的方式制造和逃离生物膜,使用通讯分子的变体,产生不同的蛋白质等等。然而,正如这些方法所表明的那样,我们越来越接近可以帮助人们的治疗方法,尽管这种治疗方法可能需要利用抗生物膜策略的组合来摧毁威胁我们生命的细菌城市。

