米歇尔·博耶额外获得了六年的生命。凯伦·科勒经历了六年几乎无症状的生活,她以为自己已经战胜了疾病。道格·奥尔森在自认为无药可救的十年多后,被正式宣布“治愈”。在过去的十年里,数千人体验到了通过操纵免疫系统来治疗癌症的方法所带来的希望和挑战,这些人就是其中的三个例子。免疫疗法不是从外部攻击癌症——切除肿瘤或用有毒化学物质或放射线灌注身体——而是激活其防御网络的复杂且高度互动的细胞和分子信号,从而从内部完成这项工作。
与那些较老的方法一样,免疫疗法已成为血液癌症(如奥尔森和科勒的癌症)和黑色素瘤(如博耶的癌症)以及膀胱癌、乳腺癌和肺癌(后者是美国最大的癌症杀手,2021年导致超过13万人死亡)等癌症治疗的支柱之一。
这种转变是巨大的,从十年前刚进入肿瘤学家的视野,到五六年前开始流行。“癌症研究和临床肿瘤实践的重心都发生了180度的转变,”加州基因泰克公司癌症免疫学副总裁艾拉·梅尔曼说。免疫疗法“已成为肺癌的标准疗法,而不久前肺癌还只能通过手术或化疗,或两者兼施来治疗。”到目前为止,结果令人鼓舞,但远非普遍适用,而且进展并没有“我们许多人预期的或希望的那么快,”西雅图弗雷德·哈钦森癌症研究中心的免疫疗法研究员斯坦利·里德尔说。“治愈癌症并不容易。”现在,数以万计的患者接受了这种治疗,在某些情况下,治疗创造了近乎奇迹的效果,而在另一些情况下,希望破灭。
支持科学新闻报道
如果您喜欢这篇文章,请考虑通过以下方式支持我们屡获殊荣的新闻报道: 订阅。通过购买订阅,您正在帮助确保有关塑造我们当今世界的发现和想法的具有影响力的故事的未来。
医生们仍然处于理解免疫疗法将帮助哪些患者以及哪些患者不会被帮助的早期阶段。起作用的因素似乎包括有多少T细胞已经进入肿瘤微环境,免疫系统识别癌细胞有多困难,甚至包括患者的肠道微生物组成,里德尔说。美国前总统吉米·卡特在2015年8月宣布他的黑色素瘤(最致命的皮肤癌)已扩散到肝脏和大脑时,已经快91岁了。新闻媒体准备好了讣告。但卡特接受了放射治疗,然后接受了一种免疫疗法药物,这种药物可以解除癌症对免疫系统的抑制,称为检查点抑制剂。到当年12月,他体内所有肿瘤的证据都消失了,此后他庆祝了97岁生日。他很可能看到了如此惊人的益处,因为他的癌症是由多年的阳光照射引起的,这引发了各种各样的突变。突变和放射损伤使他的癌细胞更容易被他的免疫系统识别,一旦免疫疗法解除了抑制。
博耶是西雅图居民,20多岁时被诊断出患有晚期黑色素瘤,因此她的癌症可能是较少突变的产物。2013年,她开始接受一系列革命性的治疗——其中一些治疗在2011年首次问世——这些治疗促使她的免疫系统识别、攻击和缩小肿瘤。但即使释放了免疫系统,也不足以引发全面的攻击,她于2019年去世,享年32岁。
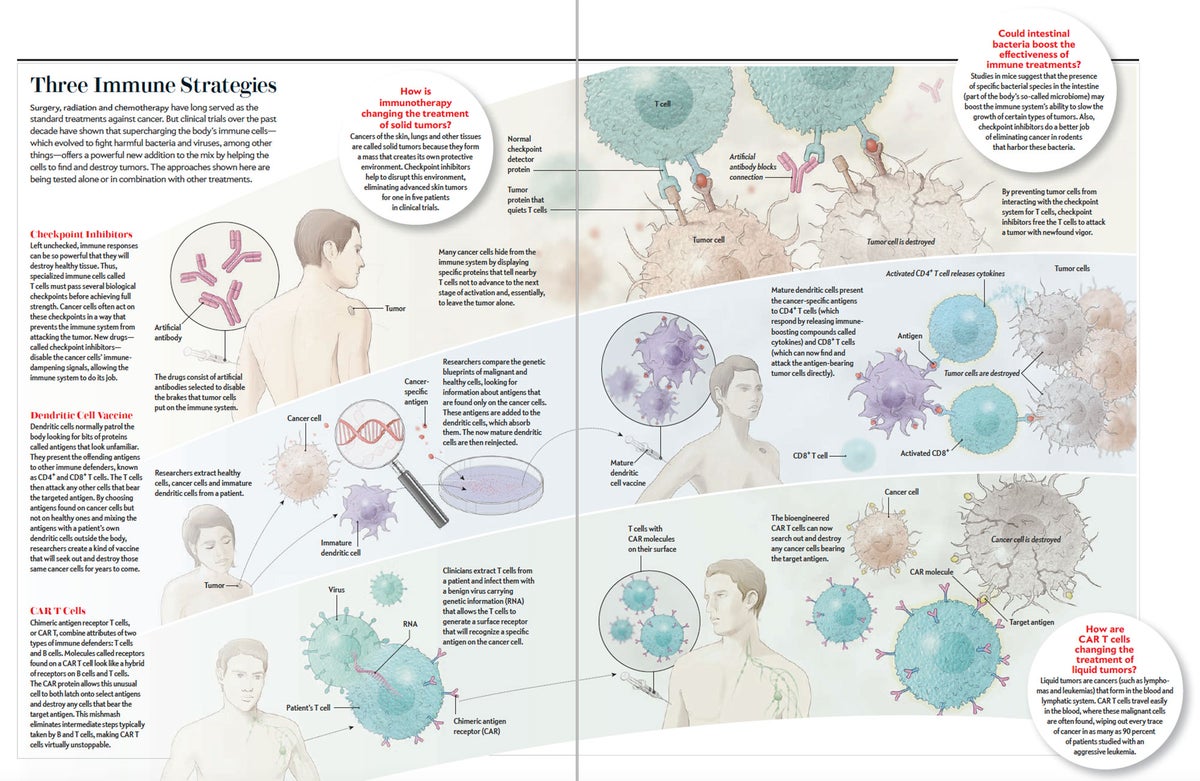
除了个体癌症的突变负荷外,医生们对谁将在这些药物上表现良好或不良知之甚少。多年来,他们一直在寻找可以预测的分子标记物,但他们没有取得多大成功。在继续寻找的同时,研究人员正在测试药物组合和其他方法,例如疫苗接种,以将益处扩展到更多患者。之所以需要这样的组合,既是因为癌症很复杂,是各种基因突变的产物,也是因为正如免疫学家所了解的那样,免疫系统具有多层防御和攻击。“你需要真正结合、协同不同的作用模式,”癌症免疫疗法先驱厄兹勒姆·图雷奇说,她与人共同创立了BioNTech,该公司现在因与辉瑞合作开发新冠疫苗而闻名。“具有非冗余、部分重叠作用模式的不同任务部队被结合在一起。这就是免疫系统自然进化的方式。”
液体的成功
利用免疫系统对抗癌症的梦想至少可以追溯到125年前的纽约市的威廉·科利,这位医生将一些细菌注射到他的癌症患者体内,试图启动他们身体的自然愈合能力。科利的方法被其他一些医生采用。但在他1936年去世后,这种方法逐渐失宠,被化疗的进步以及后来的激素和抗体疗法所取代,后者在更多患者身上显示出更一致的效果。
然而,增强免疫系统的想法从未完全失去吸引力,部分原因是纽约市的癌症研究所推动了这一想法,该研究所是科利的女儿于1953年创立的慈善机构。图雷奇说,这个领域在几十年里一直没有受到重视,但在最近几年,随着艾滋病毒研究加深了对免疫系统的理解,遗传学使人们能够更深入地了解肿瘤,癌症研究人员已经用强大的免疫武器充实了他们的武器库。
这些武器中最具吸引力的目标是循环系统和淋巴系统的癌症,如白血病和淋巴瘤。这些疾病发生在各种祖细胞(称为干细胞)身上,这些干细胞通常会产生红细胞和白细胞(以及其他组织),当它们发生突变并失控生长时,会挤占健康细胞并剥夺身体的重要功能。许多所谓的液体肿瘤是在称为B细胞的免疫系统的一部分出现问题时形成的。正常情况下,B细胞产生对抗细菌和病毒的抗体。(B细胞还与其他一组细胞T细胞一起,帮助协调各种其他免疫反应。)但是,当B细胞癌变时,它们会从内部摧毁身体。
在20世纪后期,研究人员开发出一种生物等效的制导导弹,它可以附着在B细胞蛋白(CD20)上,这种蛋白存在于细胞表面的特定晚期阶段。这种单克隆抗体被称为利妥昔单抗,它向T细胞发出信号,让它们做一些它们通常不做的事情:攻击和摧毁这些较老的、携带CD20的B细胞。然而,CD20不是癌症特异性标记物,它也出现在正常B细胞以及危险的B细胞上,因此该药物既杀死了健康的B细胞,也杀死了癌变的B细胞。然而,事实证明,大多数人可以在没有B细胞的情况下生存。(对于T细胞来说并非如此,数百万感染了靶向T细胞的艾滋病毒的人的死亡悲剧性地证明了这一点。)并且在药物失效后,大多数患者最终又开始从骨髓中的干细胞储备中自行产生B细胞。20世纪90年代的临床试验表明,化疗和利妥昔单抗的组合对基于B细胞的癌症特别有效。
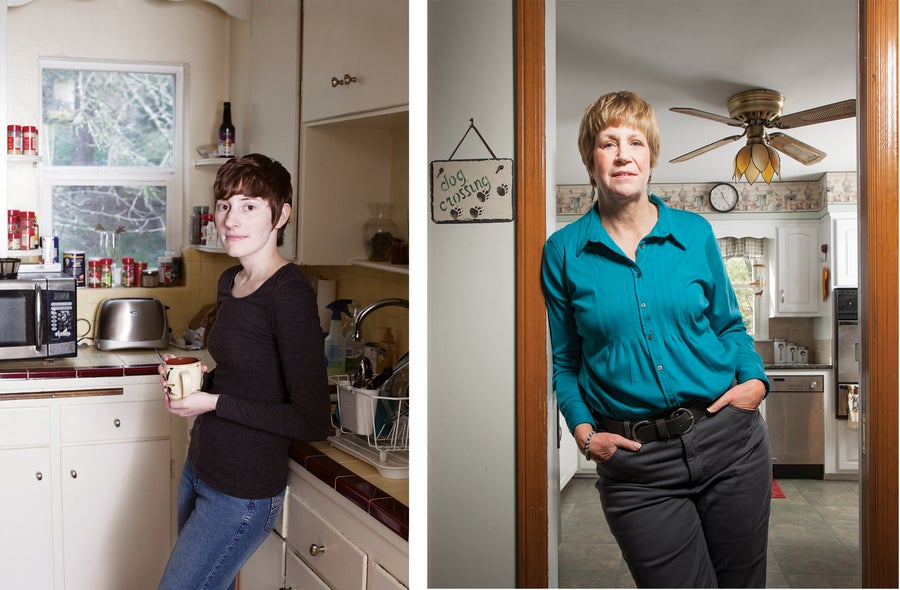
米歇尔·博耶(左图)在2013年得知自己患有晚期皮肤癌。六个疗程的免疫疗法让她多活了六年,直到2019年去世,享年32岁。凯伦·科勒(右图)在接受了自体免疫细胞输注后,无癌六年,这些免疫细胞经过基因工程改造,可以根除她的白血病。(照片拍摄于2016年。)图片来源:安妮·玛丽·穆塞尔曼(左图),艾米·埃克特(右图)
对于来自新泽西州帕克里奇的退休特殊教育教师科勒来说,白血病起源于突变的B细胞,但利妥昔单抗使她病情非常严重,而且似乎只有部分有效,因此她停止服用。此外,测试表明她的癌症会对标准化疗产生抵抗力。由于她的恶性肿瘤迅速恶化,她的医生建议采用当时仍在实验中的免疫治疗,该治疗是为对抗她的白血病类型而专门设计的。她同意了。目标是像利妥昔单抗那样摧毁科勒的所有B细胞,但有两个关键区别。B细胞上的不同蛋白质CD19是标记物。医生们没有使用药物在蛋白质上涂上靶点,吸引科勒体内已经存在的杀伤性T细胞,而是采取了更直接的方法。他们取出了一些她的T细胞,并对其进行基因工程改造,使其无需任何提示即可攻击CD19。
研究人员将这些增强型细胞称为嵌合抗原受体T细胞,或CAR-T细胞。它们表现出一些T细胞和B细胞的特征,这与古代神话生物喀迈拉被认为是不同动物组成的非常相似。美国食品和药物管理局迄今已批准了一些CAR-T细胞,它们针对CD19或其他细胞表面标记物。以前,CAR-T细胞主要在其他疗法失败后作为最后的手段使用,但现在它们正在疾病早期阶段被推广,此时患者——以及他们的免疫系统——可能更健康,反应更灵敏。里德尔说,他对通过更早地治疗患者,或许通过使用旨在同时靶向CD19和CD20以及其他抗原的CAR-T细胞组合来取得改进持乐观态度。他指出,在最近针对复发性淋巴瘤患者的三项试验中,接受CAR-T细胞治疗的患者比目前的标准护理骨髓移植患者表现更好。
奥尔森也在CAR-T细胞疗法获批之前很久就自愿参加了一项CAR-T细胞试验。作为2010年在宾夕法尼亚大学报名参加实验疗法的前三名患者之一,他认为这是他战胜他已经患病14年的慢性淋巴细胞白血病的最后机会。在输注几周后,他最终因流感样症状住院,这是该疗法的三大主要副作用之一。如此多的癌细胞迅速死亡,以至于它们的清除损害了他的肾脏。三天后,他的病情稳定下来,他的肿瘤学家大卫·波特给他带来了一个好消息:他骨髓中已经有19%的T细胞是由靶向CD19的CAR-T细胞组成的。在输注一个月后,它们占他T细胞的100%,并且完全没有癌症迹象残留。
奥尔森说,他再也没有受到该疗法的副作用困扰,尽管他的CAR-T细胞一直在杀死他健康的B细胞,因此他需要每月输注IVIG(静脉注射免疫球蛋白),这是一种有助于抵抗疾病的抗体。在2022年2月发表在《自然医学》杂志上的一项研究中,宾夕法尼亚大学的研究人员表明,他的一些T细胞以及另一位在同一时间接受治疗的患者(此后死于新冠肺炎)的T细胞,在近十年后仍然带有CAR-T细胞的特征,并且能够在实验室培养皿中杀死白血病细胞。奥尔森体内残留的CAR-T细胞已经从杀伤性T细胞转变为更像哨兵的CD4+ T细胞。这表明像奥尔森这样的患者对CAR-T细胞的反应有两个不同的阶段:一个阶段是杀伤性T细胞攻击肿瘤细胞,第二个阶段是这些CD4+ T细胞通过巡逻寻找任何残留的癌症来维持长期缓解。
这种演变可能不会发生在每个人身上。也许这就是为什么科勒的缓解并没有导致她被治愈。到2016年,在单次输注源自她自身、经过改造的细胞的CAR-T细胞一年多后,当时59岁的科勒确信自己中了免疫疗法的头彩。在她接受治疗的一个月内,扫描显示她体内没有癌症迹象。但她已经遭受了CAR-T细胞可能产生的另一种严重副作用。在她接受重新设计的细胞的当晚,一场所谓的细胞因子风暴让她住进了重症监护室。当比平时多得多的T细胞一次性被激活时,就会发生这种反应,从而引发免疫系统用来交流的大量化学信号(称为细胞因子)。结果可能是危及生命的活动狂潮,其中免疫细胞破坏健康组织,导致多器官衰竭。里德尔将其比作体内炎症的爆发。科勒在重症监护室住了八天,其中一半时间她处于昏迷状态,完全没有反应。她对那段时间没有任何记忆,但在某个时候,狂热的高尔夫球手科勒是如此的语无伦次,以至于她要求护士帮忙为两位著名的高尔夫球手准备午餐。
图片来源:Shizuka N. Aoki
到2015年3月初她出院时,科勒非常虚弱,但正在迅速恢复。骨髓测试显示没有癌症的证据,三周后她又回到了高尔夫球场。科勒是最早忍受这种戏剧性的、危及生命的细胞因子风暴的临床试验志愿者之一。她说,她也是她的医生最后一位最终进入重症监护室的患者。今天,作为一名志愿者,科勒在为即将接受CAR-T细胞治疗的患者提供咨询时,她告诉他们,他们将住在医院对面的一间公寓里,可能需要住院几天。但“没有人真的会生病,”她说。“没有人会像她在妄想期间那样,认为自己身处怀俄明州。”
CAR-T细胞的另一个挑战是其惊人的价格标签。这种疗法的常规费用为37.5万美元至47.5万美元。宾夕法尼亚大学的卡尔·琼在宣布2022年2月《自然医学》杂志上奥尔森参与的研究时表示,成本很高,但比试图用其他效果较差的疗法维持一个人的生命要便宜。降低成本的工作也在进行中。到目前为止,CAR-T细胞主要在学术医疗中心的小型研究实验室制造后给予。但140家生物技术公司和每家大型制药公司都对这种疗法的成功印象深刻,已经开始参与其中,并应很快根据改进的制造技术和市场竞争,以更低的成本大规模生产这些细胞,纽约市纪念斯隆-凯特琳癌症中心细胞工程中心主任米歇尔·萨德兰说。
奥尔森的结果表明,只有少数细胞克隆——在他的案例中,只有三个克隆占多数——是持久的。萨德兰说,如果研究人员能够弄清楚这些稀有细胞的特殊之处,并只提供这些细胞,而不是数百万其他细胞,那么治疗成本将大幅下降。研究人员还在尝试开发不太个性化、更现成的细胞治疗方法,但仍然有效,这可能会大大降低成本。
CAR-T细胞治疗面临的另一个主要挑战是将液体癌症的成功经验转化为实体肿瘤——即在乳房、前列腺、肺、皮肤和其他组织中形成肿块的那种肿瘤。梅尔曼解释说,CAR-T细胞可能很难离开血液去寻找实体肿瘤。在血液中,液体肿瘤细胞相对容易被CAR-T细胞定位。更重要的是,液体癌症的CAR-T细胞可以特异性和安全地靶向受影响的细胞谱系。实体肿瘤中没有可比的细胞谱系;它们不表达正常组织也表达的表面分子。但梅尔曼看到了这种免疫系统操纵的巨大长期潜力。“与我认为当你可以将细胞工程的全部力量用于解决问题时可能实现的目标相比,我们现在看到的CAR-T细胞仍然是初步的,几乎是粗糙的方法,”他说。
固态
实体肿瘤对免疫治疗提出了其他困难。它们通常被结缔组织和其他组织的基质包围,这阻碍了细胞进入恶性肿块。此外,实体肿瘤的内部压力通常高于周围环境的压力,这往往会冲走免疫系统用来标记异常细胞的化学信号——更不用说许多药物了。
然而,这些肿瘤已经显示出一定的脆弱性。2011年,FDA批准了一种名为伊匹单抗的单克隆抗体来治疗晚期黑色素瘤。与传统疗法不同,伊匹单抗并非旨在直接杀死肿瘤;相反,它释放了某些癌症能够抑制免疫系统的生物制动器,从而解放身体的防御能力,使其更好地发挥作用。(卡特接受了第二代检查点抑制剂帕博利珠单抗的治疗。)
黑色素瘤有一种欺骗免疫系统细胞的恶习。癌细胞团块的表面有各种各样的畸形蛋白质,T细胞应该发现这些蛋白质,蜂拥而至并摧毁它们,以防止异常生长有机会变得更大。但每隔一段时间,一个新生肿瘤就会发展出一种方法来发出化学信号,告诉T细胞一切安好并停止行动。
实际上,癌细胞劫持了免疫系统的正常功能:一种安全机制,可以在身体的横冲直撞的防御细胞开始破坏健康组织之前将其抑制住。更具体地说,这种安全机制由一系列检查点或关卡组成,这些检查点或关卡根据存在的化学信号,要么集结防御细胞进行攻击,要么关闭它们。(如果检查点卡在“打开”位置,那么随之而来的免疫反应可能会比任何恶性生长更快地杀死一个人。)
癌细胞有变通方法,使它们能够通过禁用可能杀死它们的T细胞来躲避免疫系统。用伊匹单抗或其他检查点抑制剂阻断这种虚假信号会重新唤醒免疫细胞,使它们能够再次锁定目标。伊匹单抗很快被证明对肺癌以及黑色素瘤有效,制药公司开始开发其他使用相同策略的药物。
2015年《新英格兰医学杂志》上的一项研究表明,与仅使用一种检查点抑制剂相比,使用两种检查点抑制剂的黑色素瘤患者效果更好。尽管如此,医生们仍然不擅长预测谁会对哪种检查点抑制剂或治疗组合产生反应,因此一些患者不得不不断尝试不同的疗法。今天,大约一半接受联合检查点抑制剂治疗的人在治疗后至少存活了六年。更令人困惑的是,一些似乎没有吸引到多少T细胞的肿瘤仍然对检查点抑制剂有反应,而这些药物有时对含有大量T细胞的其他肿瘤无效——这表明癌症正在玩其他花招。
正如博耶的经历所表明的那样,这使得为特定个体选择有效的实体肿瘤治疗成为一种反复试验的过程。在切除背部癌变的痣两年后,博耶得知黑色素瘤复发并扩散到她的肺部和胸部。由于肿块太大无法切除,博耶听从了医生的建议,同意在2013年初参加一项临床试验,她将在其中注射高剂量的白细胞介素-2 (IL-2),这是一种有助于增强免疫系统对抗癌症能力的数十种不同化学信号之一。起初,这种药物似乎阻止了博耶肿瘤的生长,但在三个月后,扫描显示癌症再次转移。
博耶选择了第二次临床试验,这次是将最近批准的检查点抑制剂伊匹单抗与另一种免疫信号分子IL-21配对。然而,在几周内,IL-21治疗的副作用(恶心、腹泻和难以忍受的疼痛)变得非常严重,以至于博耶不得不停止注射,尽管她继续接受伊匹单抗治疗。到2013年底,一些癌变部位开始扩大,因此她的医疗团队选择放射治疗以试图限制生长。到第二年春天,其中一些肿瘤变小了,但新的肿瘤出现在她的头部和乳房中。
手术切除了她乳房中的肿块,另外两种增强免疫力的疗法似乎在一段时间内控制住了她其余的肿瘤。然而,到2015年1月,很明显她需要另一个行动计划——新的病灶开始在她的脑部、乳房和腹部生长。一个月后,她参加了一项临床试验,该试验将另一种检查点抑制剂与一种旨在减缓肿瘤生长的药物结合使用。博耶的癌变部位在一段时间内保持稳定,但最终恶化。
这些治疗摧残了博耶的身体。到2016年末,她晚上和白天的大部分时间都在豪华的沙发椅上休息背部。在她第六轮治疗期间,她能够每天上午在结构工程师的岗位上工作。否则,她就通过玩视频游戏来消遣——《使命召唤》是她最喜欢的。她并不后悔她的医生正在用她的癌症玩打地鼠游戏。“在我看来,这些疗法中的一些疗法可能稍微减缓了生长速度,”她在2016年说。博耶记得她的一位医生“说黑色素瘤游戏的一部分不一定是现在找到正确的治疗方法,而是让自己活得足够长,直到他们找到正确的治疗方法。”
不幸的是,对于博耶来说,他们没有找到。她的2019年6月13日的讣告指出,她参加了临床试验,“希望能为未来的患者找到治疗方法。”她非常感谢她在西雅图癌症护理联盟和华盛顿大学医疗中心接受的杰出医疗护理,并且她“希望人们知道她对自己的死亡感到平静。”
展望未来
免疫疗法可能为博耶争取了更多时间。这对癌症研究人员来说是有希望的,即使结局并不像童话故事那样完美。研究人员不再需要担心他们的研究最终是否会帮助某人;现在他们可以花时间使有效的治疗方法变得更好。“我们需要找到边界和局限性”,并弄清楚如何与免疫系统合作,从而更有效地对抗更广泛的癌症类型,梅尔曼说,但“这是一种非常鼓舞人心和激动人心的方式来做科学。”
梅尔曼认为,最终,基于患者肿瘤的特征性免疫学特征,选择免疫治疗的过程将变得更加合乎逻辑。患有实体肿瘤的患者将首先进行活检,以检查是否存在T细胞。如果肿瘤中有足够的T细胞,这个人很可能会接受单一检查点抑制剂或几种抑制剂。(目前,FDA已批准八种检查点抑制剂,还有更多正在开发中。)如果肿瘤尚未吸引许多T细胞,或者T细胞无法进入肿瘤,科学家将不得不寻找其他方法来产生、吸引或促进肿瘤特异性T细胞的进入。
研究人员还在考虑如何使用标准癌症护理,包括放射治疗、靶向药物(如突变型K-Ras抑制剂)和化疗,以增强免疫反应。用较低剂量的化疗或放射治疗杀死大量肿瘤细胞应该会释放大量来自肿瘤的细胞碎片,从而提醒免疫系统向任何残留的异常生长发送T细胞。(正确地掌握平衡可能很棘手,因为过多的化疗和放射治疗也已被证明会抑制免疫系统的某些部分。)然后,添加检查点抑制剂可能能够有效地对抗虚弱的癌症,使其没有机会恢复。
其他组合方法可能很快包括癌症疫苗。图雷奇的BioNTech等公司一直在研究实验性疫苗,这些疫苗有一天将能够刺激免疫系统攻击癌症。到目前为止,BioNTech在治疗接受过手术但复发风险高的结肠癌患者以及旨在攻击个体黑色素瘤的个性化疫苗方面取得了最佳进展。图雷奇说,疫苗可以触发身体产生更大的T细胞军队,然后检查点抑制剂使这些T细胞能够在体内自由漫游并攻击残留的肿瘤细胞。
图雷奇说,添加疫苗也可能帮助那些对检查点抑制剂有一定反应(如博耶)但没有长期获益的患者。信使RNA(mRNA)是BioNTech强大的新冠疫苗中使用的相同载体,是免疫疗法的天然工具,她补充说。它通过触发比早期癌症疫苗(被证明太弱)更强的免疫反应来放大抗原的作用。它也适用于个性化疫苗,因为可以轻松地将一种mRNA换成另一种。“疫苗现在进入了一个新时代,”她说。
其他研究人员正在操纵T细胞受体(TCR)以鼓励它们攻击癌细胞,或者使用肿瘤浸润淋巴细胞(TIL),这些淋巴细胞从体内取出,在实验室中扩增数量,然后重新输注。美国国立卫生研究院的史蒂文·罗森伯格已经表明,大约15%到20%的患者从TIL获得显着反应,到目前为止,治疗后存活期长达15年。“问题是,我们如何使这个比例更大?”里德尔问道。
研究人员正在更多地了解T细胞衰竭,这是一种免疫战士似乎只是放弃战斗的状态。单细胞测序正在以前所未有的精细程度提供见解。里德尔说,基因编辑使科学家能够将这些新知识投入到实际应用中。因此,新的进展势必会到来。正如他指出的那样,化疗优化花了50年时间,而检查点阻断和CAR-T细胞疗法才出现十年。“免疫系统根除癌症的潜力确实非常显着,”里德尔说。如果癌症是一座山脉,“我们已经攀登了第一座高峰,但还有更多高峰。”
当然,所有这些新的疗法和组合疗法都将是昂贵的。据医疗保健数据公司 IQVIA 称,到 2025 年,全球肿瘤药物市场预计将超过每年 2500 亿美元。保险公司和公众不愿意也无法无限期地组合那些可能使每位患者花费数十万美元或更多的药物。因此,各公司正在研究生产改进、降低剂量和缩短治疗时间等方法,以降低治疗成本。但是,更多治愈所能提供的价值是无可辩驳的。
现年 65 岁的科勒从她的基因工程 T 细胞中获得了六年美好的时光。除了静脉注射免疫球蛋白和定期检查外,她能够过上正常的生活。“我感觉棒极了,”她说。而且它持续了这么长时间,以至于她“有点自负”,认为她的癌症日子已经结束了。但 2021 年底的扫描显示,她的白血病又卷土重来。截至撰写本文时,她仍在等待她的医生完成血液分析并推荐下一步的治疗方案。
她说:“如果我们能再次进行 CAR T 疗法,我现在就开车去医院。”医生仍然保留着她的细胞,但 CAR T 疗法尚未获准二次使用,而且目前尚不清楚她目前的癌细胞表面是否具有相同的 CD19 受体。科勒最终可能会服用一种名为伊布替尼的药物,这是一种常用于治疗慢性淋巴细胞白血病的免疫疗法——但她必须终生服用。她告诉她的医生,她宁愿再接受一轮 CAR T 疗法:“我不想维持治疗。我想让你再次击退它。”癌症医生希望免疫疗法很快就能让他们为更多患者延长高质量的生命。