在漫长而常常令人沮丧的癌症治疗探索中,1998年赫赛汀 (Herceptin) 药物的批准是一个极具希望的时刻。这种乳腺癌药物是首个使用肿瘤特异性蛋白作为归巢信标来寻找和杀死癌细胞的药物。而且它奏效了。自那时以来,赫赛汀已使约三百万人受益,显着提高了曾是最糟糕的医学诊断之一的10年生存率和无癌率。“老实说,这有点像天翻地覆的变化,”波士顿达纳-法伯癌症研究所 (Dana-Farber Cancer Institute) 的肿瘤学家萨拉·M·托拉尼 (Sara M. Tolaney) 说。
但该药物有一个主要的局限性。赫赛汀的信标是一种名为 HER2 的蛋白质,它最适用于肿瘤受 HER2 信号刺激生长的患者——但这仅占乳腺癌患者的五分之一左右。对于美国每年约 25 万被诊断出患有该疾病的其他 80% 的人来说,赫赛汀没有任何益处。
对更好疗法的 Hunt 促使研究人员重新构想靶向疗法。到 2022 年,他们开发出一种将赫赛汀与另一种抗癌药物联系起来的疗法。这种疗法首次可以损伤 HER2 水平极低的肿瘤。这种名为 Enhertu 的药物延长了乳腺癌患者的寿命几个月,有时甚至更长。而且与标准化学疗法相比,它的严重副作用更少。美国食品和药物管理局 (U.S. Food and Drug Administration) 于当年批准了其使用。
关于支持科学新闻报道
如果您喜欢这篇文章,请考虑通过以下方式支持我们屡获殊荣的新闻报道 订阅。通过购买订阅,您正在帮助确保有关塑造我们当今世界的发现和想法的具有影响力的故事的未来。
2023 年,消息变得更加令人振奋。研究人员报告称,Enhertu 似乎甚至对那些看起来完全没有 HER2 的肿瘤也有效。(癌症可能确实含有这种蛋白质,但水平非常低,以至于逃脱了标准检测方法。)“太令人兴奋了!”纽约市纪念斯隆·凯特琳 (Memorial Sloan Kettering, MSK) 癌症中心的肿瘤学家沙努·莫迪 (Shanu Modi) 说,他帮助进行了导致 Enhertu 获批的研究。“他们进行了这项具有启发性的测试,并在显然缺乏这种癌症蛋白质的肿瘤中看到了近 30% 的缓解率,”她指出。
“几乎每个参与该药物治疗的患者都获得了益处。这真的非常令人满意。”——沙努·莫迪,《MSK 癌症中心》
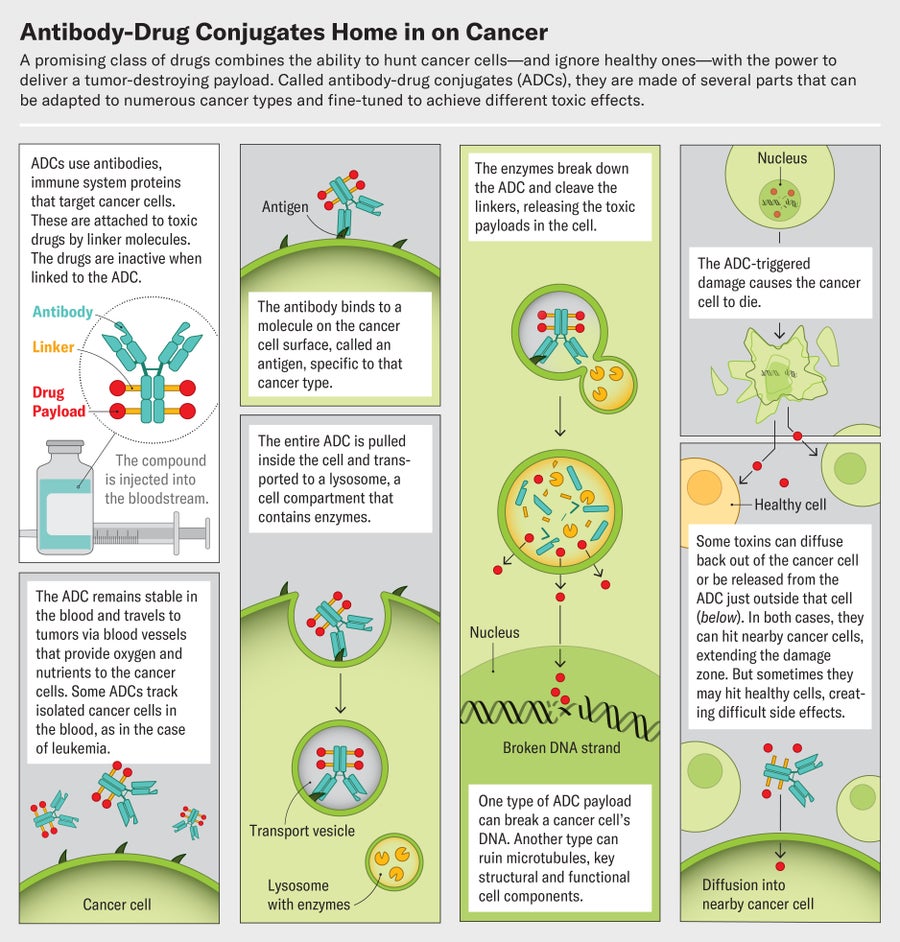
Enhertu 属于一类巧妙且不断增长的靶向抗癌药物,称为抗体-药物偶联物,或 ADC。这些化合物围绕一种特定的抗体构建,这是一种免疫系统蛋白质,可靶向癌细胞上大量存在的分子。该抗体与一种有毒有效载荷(一种杀死这些细胞的药物)相连。ADC 对癌症的亲和力意味着它可以放过健康细胞,从而避免了传统化学疗法的许多副作用。每种抗体都可以与几种不同的药物配对。这种类似乐高积木的组装方式开辟了一个混合搭配的世界。研究人员可以通过更换抗体来使用同一种药物治疗多种癌症,或者他们可以使用多种不同的 ADC 攻击一种类型的肿瘤,这些 ADC 靶向细胞上的多种癌症生物标志物。托拉尼说,这种能力“改变了我们对药物开发的看法”。
ADC 的想法并非完全是新的——第一个 ADC 于 2000 年获准用于患者——但最近科学家们已经掌握了精细的化学构建技术,使这些化合物更加有效,并且他们已经确定了新的癌症特异性靶点。这些进步推动了新一轮的发展浪潮。至少有 14 种 ADC 已获准用于乳腺癌、膀胱癌、卵巢癌、血液癌和其他癌症。大约还有 100 种正在临床前研发中。一种名为 T-DM1 的乳腺癌 ADC 已被证明比赫赛汀更有效,并已成为早期疾病的标准护理。“看到事情变化如此之快,真是太酷了,”托拉尼说。
在这些成功的鼓舞下,研究人员和制药公司正在投入资源开发更强大的 ADC——甚至可能开发出可以广泛用于多种癌症类型的 ADC。吉利德 (Gilead)、罗氏 (Roche) 和 BioNTech 等制药巨头已在其 ADC 计划中投入巨资;例如,2023 年 10 月,默克 (Merck) 向与阿斯利康 (AstraZeneca) 合作生产 Enhertu 的生物技术公司第一三共 (Daiichi Sankyo) 投资了 40 亿美元。
但这些新药仍然受到一些神秘问题的困扰。一些 ADC 具有与传统化学疗法类似的副作用——这不应该发生,因为这些药物应该只靶向癌细胞。在患者论坛上,人们描述说由于无法忍受的恶心或疲劳而需要减少剂量。这些缺点限制了 ADC 的使用,因此科学家和制药公司正在紧急尝试找出导致这些缺点的原因。
在导致 Enhertu 获批的临床试验中,患者通常已经接受过不同类型的化学疗法药物,例如阻止细胞繁殖的药物。但这些药物——以及其他形式的化学疗法——无法区分癌细胞和健康细胞。任何试图制造 DNA 或繁殖的细胞都很脆弱,正常组织和肿瘤都可能受到攻击。完全有 64% 的接受标准化学疗法的人会出现恶心、腹泻、疲劳和其他负面副作用。对于许多人来说,这些副作用可能与癌症本身一样令人虚弱。这些影响限制了人们可以服用的剂量和治疗时长,为肿瘤产生耐药性和反弹留下了机会之窗。
多年来,研究人员一直在寻找毒性较小的替代品,设想出靶向癌症并放过健康细胞的精准药物。ADC 的想法源于抗体的精确特异性。如果可以将高毒性形式的化学疗法捆绑到抗体上,那么毒素将仅到达癌细胞,而不会到达其他细胞。尽管概念很简单,但制造 ADC 的尝试却停滞了几十年。
最早的一些尝试使用了效果不够强的药物。例如,在 20 世纪 50 年代,研究人员将一种名为甲氨蝶呤的药物与一种靶向癌胚抗原(一种常见的肿瘤标志物)的抗体连接起来,并测试了该构建体是否可以治疗人类的晚期结直肠癌和卵巢癌。该药物与其靶点结合,但几乎没有治疗效果。然后,研究人员转向了另一个极端,尝试使用毒性更大的药物来代替。但这些药物引发了严重的副作用。
Jen Christiansen;图形顾问:Greg Thurber/密歇根大学
密歇根大学的化学工程师格雷格·瑟伯 (Greg Thurber) 研究了这个难题。当他研究抗体如何通过身体扩散以与其靶点结合时,他开始研究 ADC。瑟伯说,在 ADC 通过肿瘤的血管网络渗透到肿瘤中后,这些化合物会从这些血管中溜出并进入癌细胞以杀死它们。但当时存在的 ADC 从未越过血管外部的细胞。它们结合得太紧了。事实证明,提高疗效的关键是调整抗体部分,使其能够准确地锁定癌细胞,但又具有足够松散的抓地力,以便一些抗体可以溜入肿瘤内部。“该领域的许多人都有一个非常简单的概念——我们将化学疗法药物放在抗体上,它将其靶向癌细胞,并且它将避开健康组织,”瑟伯说。“但这根本不是它们在现实中运作的方式。”
对 ADC 的药物成分以及抗体的调整最终找到了杀死癌症的最佳点。2013 年,FDA 批准了用于治疗乳腺癌的 T-DM1。其抗体是曲妥珠单抗(T-DM1 中的“T”),与赫赛汀中使用的抗体相同。附着在该抗体上的药物非常值得关注,因为它本身使用太危险了。它被称为恩美坦辛 (emtansine),最初于 20 世纪 70 年代被发现,但由于对太多细胞具有毒性而被搁置。然而,当作为 T-DM1 连接在一起时,该药物和抗体通常会避开健康细胞,并被证明是有效且精确的组合。
在 21 世纪初,莫迪帮助进行了一项 T-DM1(其制造商基因泰克 (Genentech) 将其品牌命名为 Kadcyla)在患有特别难治疾病的人群中的试验:已扩散到全身的晚期 HER2 阳性乳腺癌。只有那些其他治疗方案已用尽的人才被招募。“我们正在接纳那些在某些情况下真的要进入临终关怀的人,”莫迪说。然而,“几乎每个参与该药物治疗的患者都获得了益处。这真的非常令人满意。”
在另一项针对约 1500 名早期乳腺癌患者的试验中,2019 年发布的临时数据分析估计,接受 T-DM1 治疗的患者中,有 88% 的人在三年后将无癌,而仅接受赫赛汀单独治疗的患者中,这一比例为 77%。莫迪说,该药物已被证明“比我们给患者的大多数疗法都更有效,并且与更好的安全性相关”。
Kadcyla 在治疗难治性癌症方面的成功不仅改变了一些患者的生活。它还激发了人们对 ADC 理念的热情——或许更重要的是,制药行业的资金也随之而来。研究人员现在知道,只要将各个部分正确地组合在一起,就有可能将抗体与毒性过大而无法以其他方式使用的药物结合起来,并生产出比传统化学疗法更有效的药物。
几种类似设计的 ADC 已获准用于治疗多种不同的癌症类型。其中许多药物携带抑制拓扑异构酶 1 的酶的药物,拓扑异构酶 1 对于 DNA 复制至关重要。与 Kadcyla 中使用的药物恩美坦辛一样,较新的拓扑异构酶抑制剂毒性过大,无法用作独立药物,但当它们主要局限于肿瘤细胞时,危害要小得多。而 Kadcyla 本身在被证明可以减缓或阻止晚期乳腺癌后,正在早期疾病患者身上进行测试,以观察此时的治疗是否不仅可以减缓癌症的发展,而且实际上可以治愈癌症。莫迪说,它的成功“有点像是持续探索的催化剂”。“我们能否在此基础上更进一步?我们能否做得更好?”
事实证明,做得更好需要设计良好的连接分子,将抗体与药物连接起来。这些微小的结构就像化学触发器。它们必须保持完全稳定,直到到达目标,然后从抗体上解开,以便在肿瘤处释放其有效载荷。最早的一些 ADC 制造尝试之所以失败,不是因为使用的抗体或药物,而是因为连接子不稳定。
现代 ADC 依赖于两种类型的连接子。一种类型的连接子即使在 ADC 到达其目标时也保持完整。另一种类型的连接子称为可裂解连接子,它们是在响应非常特定的信号(例如肿瘤中或单个癌细胞之间空间中大量存在的酶)时会断裂的化学物质。一旦 ADC 进入肿瘤边界内,这些酶就会裂解连接子并释放药物有效载荷。
可裂解连接子显示出令人印象深刻的优势,目前批准的 ADC 中有 80% 以上使用了它们。带有不可裂解连接子的 ADC 只会杀死它所附着的细胞,但分裂的 ADC 可能会将药物分子放置在相邻的肿瘤细胞附近并摧毁它们。瑟伯说,这种所谓的旁观者效应可以使药物更有效。
例如,Enhertu 使用与 Kadcyla 相同的抗体,但带有可裂解连接子(Kadcyla 使用不可裂解版本)和不同的药物。每个 Enhertu 抗体携带约 8 个药物分子,而 Kadcyla 中每个抗体携带约 3 个。在一项研究中,研究人员比较了这两种疗法对 HER2 阳性乳腺癌患者的影响。Enhertu 是明显的赢家。它平均停止肿瘤生长两年多,而 Kadcyla 仅停止肿瘤生长六个月。“就它好多少而言,这是一场压倒性的胜利,”托拉尼说。“这是一个很好的例子,说明 ADC 技术如何导致结果发生巨大差异。”
旁观者效应还在一定程度上解释了为什么 Enhertu 对几乎没有 HER2 的肿瘤也有效:一旦 ADC 进入肿瘤并且药物分子脱离,即使那些旁观者细胞表面没有携带太多 HER2,它们也可以杀死相邻的肿瘤细胞。这种作用,以及使用可能遗漏极低 HER2 水平的诊断测试,可以解释该药物似乎对没有 HER2 的肿瘤有效的试验结果。该试验采用了一种称为 IHC 测试的分析方法。它通常用于将癌症分为 HER2 阳性或阴性,而不是测量存在的蛋白质数量。阴性结果通常意味着肿瘤细胞表面只有 10% 或更少的细胞具有 HER2。然而,10% 可能足以吸引一些 Enhertu 颗粒,而旁观者效应可能足以摧毁肿瘤细胞,莫迪说。
Enhertu 并不是唯一一种似乎以这种方式起作用的 ADC。在 2022 年的一项研究中,研究人员发现,Trodelvy(一种靶向称为 TROP2 的表面蛋白的 ADC)对于转移性三阴性乳腺癌(一种特别难治的疾病)患者,似乎比标准化学疗法更有效。无论在肿瘤上检测到多少或多少的 TROP2,Trodelvy 都更有效。“这对我来说太疯狂了,”托拉尼说。“我们对此感到兴奋,因为这些癌症在 [显然] 没有靶点的情况下也获得了益处。”
新一代 ADC 正在以前被认为难以治疗的其他类型癌症(例如转移性膀胱癌)中发挥作用。2021 年,FDA 批准了 Trodelvy 和另一种名为 Padcev 的 ADC 来治疗这种疾病。在南加州霍格家庭癌症研究所 (Hoag Family Cancer Institute) 治疗泌尿生殖系统癌症的肿瘤学家大卫·J·本杰明 (David J. Benjamin) 说,30 年来,治疗这种类型膀胱癌的标准护理一直是单独化疗。“现在我们有了多种新疗法,其中两种恰好是抗体-药物偶联物,”本杰明说。在晚期膀胱癌患者的临床试验中,Padcev 与一种刺激免疫系统的药物联合使用,使超过 60% 患者的肿瘤缩小或阻止其生长。在接受这两种药物联合治疗的患者中,高达 30% 的患者的癌症完全消失——这是前所未有的成功。
但即使是更新的 ADC 也并非没有问题。旁观者效应使其非常有效,但也会从肿瘤扩散得足够远以影响健康细胞,从而导致脱发、恶心、腹泻、疲劳和其他副作用,这些副作用与老式化疗的后果惊人地相似。ADC 也与各种眼部问题有关,从结膜炎到严重的视力丧失。
对这些不良影响的另一种解释是,没有癌症细胞独有的蛋白质靶点。这些蛋白质,也称为抗原,在癌症中更丰富,但也可能出现在正常细胞中。这使得 ADC 与健康细胞的一些结合不可避免。“我想不出任何真正的肿瘤特异性抗原的例子,”麻省理工学院科赫研究所 (Koch Institute at the Massachusetts Institute of Technology) 的分子生物学家马修·范德海登 (Matthew Vander Heiden) 说。此外,ADC 与任何其他药物或抗体一样,最终会被非癌细胞摄取和代谢。这个过程会将它们分解成更小的碎片,从连接子中释放有效载荷药物并引发反应。
尽管如此,分解 ADC 并调整其成分的能力——这对于传统疗法来说是不可能的——为研究人员提供了寻找副作用更少、优势更多的版本的机会。目前,大多数 ADC 都在人们可以耐受的最大剂量下使用。未来的版本可能并非如此。在开发药物时,无论是简单的止痛药、化学疗法还是 ADC,研究人员首先要找出药物有效的最低剂量。然后,他们计算出人们可以安全接受的最高剂量。这两个剂量之间的空间(称为治疗窗)通常很小。但更换成分的能力为 ADC 研究人员提供了许多拓宽治疗窗的途径。最终,制药商可能会制造出非常有效的 ADC,以至于患者永远不需要服用最大耐受剂量——较低的剂量就足以消除肿瘤,而不会产生恶心或脱发等意外后果。
改用毒性化学疗法药物作为有效载荷也可能减少患者的副作用。例如,一些已获批准的 ADC 将抗体与可以激活人体自身免疫系统攻击癌细胞的药物连接起来,而不是依赖于细胞中毒化学物质。此外,科学家们正在探索通过将抗体与放射性同位素连接来将放射疗法直接输送到肿瘤的方法。MSK 癌症中心的肿瘤学家约书亚·Z·德拉戈 (Joshua Z. Drago) 说,使用合适的连接子,ADC“理论上可以输送任何类型的小分子药物”。
最终,重组和改进的成分可能会导致癌症患者真正关心的那种转变:将他们的疾病换成治愈。

