在她一岁生日时,艾玛·拉尔森还不会走路或站立,但很多其他同龄的孩子也不会。她喜欢父母在她位于纽约长岛的家中安装的摇椅,并且充满活力地爬行。然后在 13 个月大时,艾玛的腿停止了工作。她的母亲黛安·拉尔森打了个响指说:“就像那样。”艾玛停止了弹跳。当她把自己拉起来站立时,她的腿弯曲了。她爬行的变化比较微妙,但是当她的父母看了一段旧视频时,差异很明显——艾玛现在覆盖的地面更少,并且难以抬起头。
经过一连串的测试,2014 年 7 月,拉尔森一家得知艾玛患有脊髓性肌萎缩症 (SMA),这是一种可能致命的神经退行性疾病,主要侵袭儿童,剥夺他们行走、说话的能力,最坏的情况下,还会剥夺呼吸的能力。她的运动神经元正在死亡,原因是体内严重缺乏一种名为 SMN(运动神经元存活)的蛋白质。“你会经历最黑暗的时期,”黛安说。但是这个家庭决心“奋力反击”,艾玛的父亲马特·拉尔森说。“我们愿意做几乎任何事情来对抗这种可怕的疾病。”
在离拉尔森家不远的冷泉港实验室,生物化学家和分子遗传学家阿德里安·克雷纳也在进行同样的斗争。自 2000 年以来,他一直在研究 SMA 的遗传基础,并且知道问题在于缺失或突变的关键基因 SMN1。但他也明白,人们携带该基因的一种非活性且可能可挽救的类似物 SMN2。到 2004 年,他与 Ionis Pharmaceuticals 的弗兰克·贝内特联手,试图开发一种能够改变 SMA 患者体内 SMN2 的药物,使其最终能够产生功能性 SMN 蛋白,目的是改善疾病的进展。为此,研究人员转向了一种叫做反义寡核苷酸的东西。
支持科学新闻报道
如果您喜欢这篇文章,请考虑通过以下方式支持我们屡获殊荣的新闻报道: 订阅。通过购买订阅,您将帮助确保有关塑造我们当今世界的发现和想法的具有影响力的故事的未来。
反义寡核苷酸 (ASO) 的概念最早在 40 多年前提出,它是化学修饰的 DNA 或 RNA 短链(希腊语中 oligo 的意思是“少”,核苷酸是构成 DNA 和 RNA 的结构单元)。 ASO 旨在靶向问题基因产生的 RNA 链并改变基因的表达。也就是说,ASO 与靶向 RNA 的一部分结合,以产生(或者,在某些情况下,停止产生)蛋白质,这些蛋白质的缺失(或存在)会导致疾病。几十年来,科学家们一直努力证明,这种策略可以产生一种能够治疗或预防疾病的药物,但他们发现毒性和递送方面存在严重问题,许多人因此放弃了它。然而,少数坚持下来的研究人员克服了障碍,及时从基因组学革命揭示的有关遗传疾病的详细信息中获益。“反义疗法是为有遗传原因的疾病量身定制的,”Ionis 首席执行官布雷特·莫尼亚说,他于 1 月份从创始人斯坦利·克鲁克手中接任。“它是精准医学的缩影。”
克雷纳、贝内特及其同事将他们的 SMA 药物称为 nusinersen。当注射到脑脊液中时,它会诱导非活性运动神经元基因产生 SMN。他们与 Biogen 合作,于 2011 年开始在人体临床试验中测试该药物。拉尔森一家在艾玛满两岁符合资格的那天就让她入组了。那时她已经完全不能爬了。她的第一剂药是在 2015 年 3 月注射的,随后又快速连续注射了两剂。
2015 年 5 月,黛安在卧室里,而艾玛在附近的起居室里。“我听到她在叫我,而且声音越来越近,”黛安回忆道。“接下来,她就从起居室爬到我的卧室了。”黛安问自己,“我刚才真的看到了吗?”她抱起女儿,把她抱回走廊。然后她回到卧室,喊道:“艾玛,过来。”小女孩爬到她母亲的怀里。黛安哭着想,“我们有进展了!”
的确,他们有进展了。nusinersen 的临床试验非常成功,以至于提前一年结束。美国食品药品监督管理局于 2016 年 12 月批准了该药物,品牌名为 Spinraza。目前,40 个国家的 8,400 多名患者正在服用该药物。25 名患有最严重 SMA 突变的新生儿在出生时就接受了该药物。他们现在四岁了——并且发育正常。“如果我除了开发 Spinraza 之外什么都没做,那就足够了,”克鲁克说。

黛安和马特·拉尔森与他们七岁的女儿艾玛合影。“我们有进展了!”2015 年,黛安哭着说道,当时患有脊髓性肌萎缩症 (SMA) 的艾玛在接受反义药物 nusinersen(品牌名 Spinraza)后几个月内就能爬到她身边。图片来源:伊桑·希尔
但 Spinraza 也是支持 ASO 最终充分发挥其潜力的论点的有力证据。它是第一个取得如此戏剧性成果和商业成功的 ASO。该药物为克雷纳和贝内特赢得了数百万美元的 2019 年突破奖。它还触及了一系列诱人的神经系统靶点,例如亨廷顿病和肌萎缩侧索硬化症 (ALS)。“我们在 20 世纪 90 年代发现了这些疾病的大多数遗传基础,”贝内特说。“我们花了 25 年的时间才将这些非常重要的科学发现转化为潜在的疗法。[对于 Spinraza,] 几乎令人叹为观止地意识到,我们拥有一种技术,可以对没有可用疗法的患者产生如此广泛的影响。”
就像在高海拔地区训练的长跑运动员一样,反义科学家们付出了艰苦的努力来优化寡核苷酸的化学性质和递送。现在他们处于海平面,正在冲刺。100 多种药物正在研发中,用于治疗从阿尔茨海默病到高血压等各种疾病。并非所有药物都能到达终点线,但包括 Spinraza 在内,迄今为止已有 8 种药物在美国和欧洲获得批准,全部用于罕见疾病。用于治疗亨廷顿病和 ALS 的药物正处于临床试验的最后阶段。在历史上尚属首次的情况下,波士顿儿童医院的一位医生在不到一年的时间内为一位患有超罕见疾病的小女孩定制了一种反义药物。“人们谈论生物疗法已经 30 年了,而令人惊奇的是,它开始发生了,”马萨诸塞大学医学院的神经学家罗伯特·布朗说,他是 ALS 研究的领导者。(生物药物是由活生物体制造的药物。)“这真是一场游戏规则的改变者。”
正义与反义
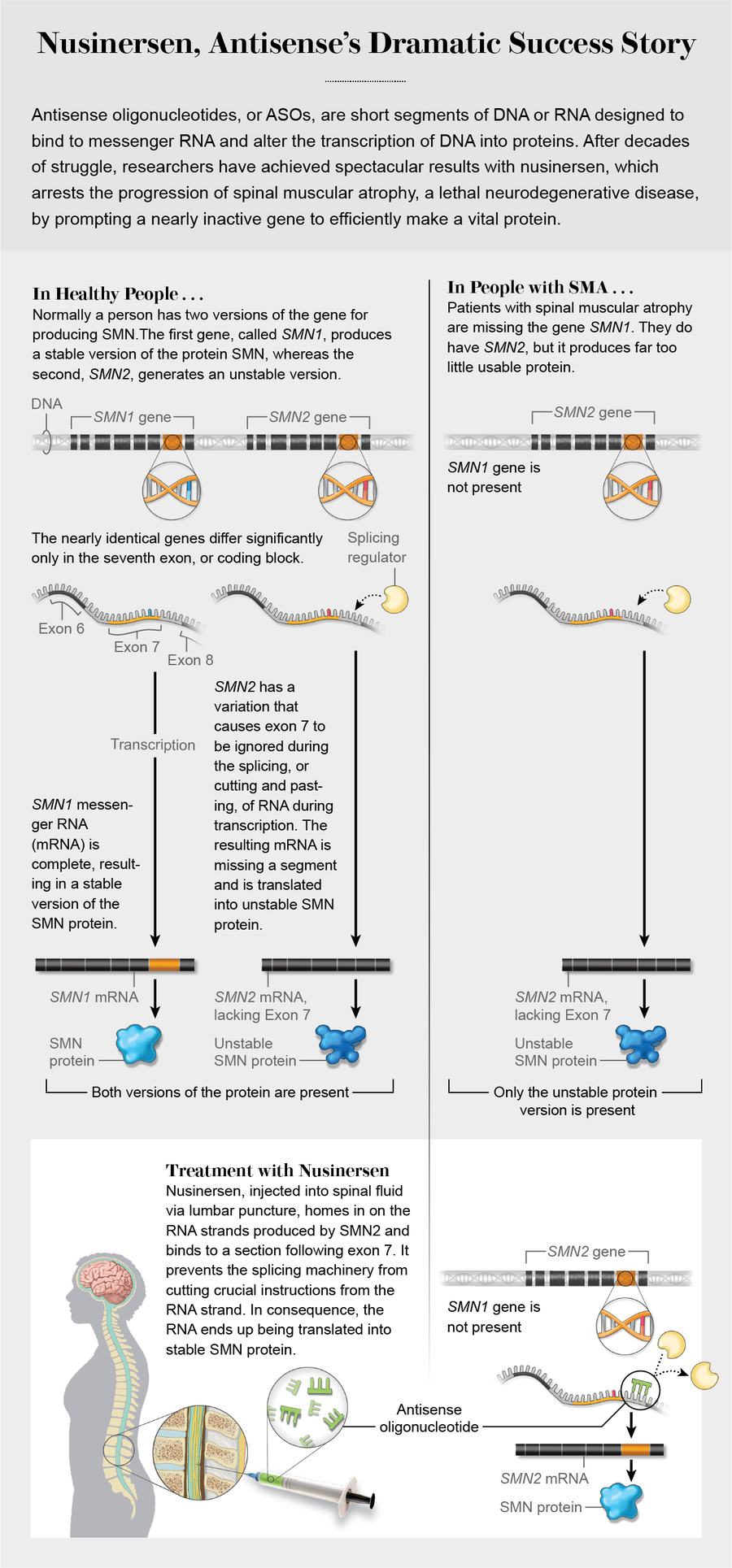
DNA 为生命提供了基本蓝图,但它必须被读取和翻译成行动,通过蛋白质的产生,蛋白质执行体内的大部分工作。由于 DNA 中编码的指令非常关键,因此翻译过程内置了保护机制。有很多重复,首先是两条核苷酸链,它们拉链在一起形成 DNA 的双螺旋结构。其中一条链充当模板,铺设构成 DNA 分子的四种碱基的序列:腺嘌呤 (A)、胸腺嘧啶 (T)、鸟嘌呤 (G) 和胞嘧啶 (C)。另一条链读取该模板并铺设一组互补的碱基。一条链上的每个碱基始终与其特定的伙伴相对:A 始终与 T 配对,C 始终与 G 配对。为了确保准确性,RNA 仅编码非模板链中的指令,用于蛋白质的产生。生物学家用各种名称称呼这两条链,包括正义链和反义链,这赋予了 ASO 技术名称。
有时,最终结果——蛋白质——并不正确。它们可能过度生产或生产不足,从而导致疾病。小分子药物是市场上大多数药物的主要成分,它们靶向与疾病相关的蛋白质。单克隆抗体是另一种主要的药物类别,通常与蛋白质结合并刺激患者的免疫系统攻击它们。相比之下,反义药物的目标是更早地中断该过程。它们旨在通过根据标准碱基配对规则卡入到位,从而在转录过程中替换错误的 RNA,从而调整蛋白质的产生。
一项并行的努力侧重于所谓的 RNA 干扰或 RNAi。这项技术是在反义疗法被放弃的时候才被发现的,因此其支持者避免使用该术语,但源自这两种方法的药物是相关的。“我认为反义疗法是属,而 RNAi 是种,”贝内特说。区别在于 RNAi 药物有两条链,而 ASO 只有一条链。但是任何短链——通常为 15 到 20 个核苷酸——都被认为是寡核苷酸。
寡核苷酸药物技术的通用性源于它分离了两个关键要素:决定药物递送和分布到组织中的平台或分子特性,以及靶向特定基因所需的碱基序列。不同的碱基序列使药物中包含的信息有所不同,但具有相同化学修饰的反义药物在体内往往表现相似。“这就是一旦建立平台以递送到感兴趣的组织,我们就能快速行动的原因,”马萨诸塞大学医学院的核酸化学家乔纳森·沃茨说。“通过洗牌碱基序列,我们可以使用来自罕见疾病患者的基因组测序实验或来自基因组数据库的信息,拨入完全不同的靶点。能够直观且合理地使用该信息非常强大。”
长跑
自 1978 年以来,就有人提出了使用遗传信息来制造可以与 RNA 结合的药物的想法。但是仍然存在许多未解答的问题:如何将寡核苷酸制成药物?为什么与 RNA 结合会产生效果?尽管如此,这个想法还是非常吸引克鲁克,以至于他在 1989 年辞去了 SmithKline(现在的葛兰素史克)研发主管的职位,成立了一家致力于反义技术开发的公司。他的妻子罗桑妮(也是一位药理学家)以及包括贝内特和莫尼亚在内的同事也加入了他的行列。(该公司最初名为 Isis,但最终因显而易见的原因更名为 Ionis Pharmaceuticals。)
大约在同一时间,其他几家公司也开始追求反义疗法,但大多数公司一家接一家地放弃了这项研究。有一段时间,毒性、脱靶效应和缺乏效力的问题似乎无法克服。*
但克鲁克和他的同事们坚持不懈地逐个解决了科学问题。Ionis 圣地亚哥总部一堵长长的专利墙证明了他们的工作。首先,他们必须开发必要的化学物质。例如,通过修饰 ASO 的 RNA 和 DNA 中核糖糖中的关键位置 (2'),他们能够增强 ASO 对 RNA 受体的亲和力,从而显着降低必要的剂量。其他化学修饰提高了安全性和耐受性。他们还发现,当药物直接递送到培养物中的细胞时,它们不会被组织吸收,但 Ionis 的科学家们还是大胆地在动物身上测试了这些药物。莫尼亚曾负责 Ionis 的药物开发,他生动地记得,当他查看他用来测量特定 RNA 水平的化学测试时,几乎没有看到任何痕迹——药物已进入大多数组织中的细胞,并且他们已成功敲低了 RNA 的表达。
贝内特说,在癌症方面花费的时间并没有取得太大的成果。(然而,更有希望、更精心设计的实验正在进行中。)真正有效的是具有特定靶点的药物,通常用于罕见疾病,对于这些疾病,概念验证更容易建立。最早的 ASO 用于眼部疾病,后来用于肝脏疾病,在这些疾病中,摄取效果特别好。这些药物是有效的,但最终在商业上不可行,因为更好的解决方案出现了。
最新的寡核苷酸药物旨在解决罕见疾病。其中一种是 Exondys 51,它靶向杜氏肌营养不良症,这是一种由产生肌营养不良蛋白的基因突变引起的严重、进行性退行性疾病。荷兰莱顿大学医学中心的 Annemieke Aartsma-Rus 是寡核苷酸治疗学会主席,她是杜氏肌营养不良症的专家,并帮助开发了这种药物。它不如 Spinraza 那么引人注目,但凭借早期显示肌营养不良蛋白水平升高的结果,该药物获得了加速监管批准。销售该药物的公司(Aartsma-Rus 在其中持有股份)需要在 2021 年之前证明它对患者的功能有意义的影响。
第一种 RNAi 药物 Onpattro 由总部位于波士顿的生物技术公司 Alnylam Pharmaceuticals 生产,于 2018 年获得批准,用于治疗一种遗传性神经损伤。一种名为 Tegsedi 的已获批准的 Ionis ASO 药物也治疗相同的疾病。现在所有寡核苷酸疗法的重点是将更多的药物更高效地递送到身体的更多部位。“很多人都处于观望模式,”Aartsma-Rus 说。“他们现在看到,如果他们不开始,他们就会错过机会。”

艾玛在她家附近的秋千上玩耍。由于包括她和其他人在内的 nusinersen 临床试验的成功,全球超过 8,400 名 SMA 患者现在正在服用该药物。这一突破推动了反义疗法领域的发展,这种疗法对于遗传性神经系统疾病似乎特别有效。图片来源:伊桑·希尔
大脑的希望
长期以来,反义公司基本上忽略了神经系统靶点,因为寡核苷酸通常无法穿过血脑屏障。但贝内特认为,通过腰椎穿刺将它们直接递送到脑脊液中可能会奏效。他力劝持怀疑态度的克鲁克让他尝试。“我有很多保留意见,但想法是要说‘是’,”克鲁克说。“‘不’永远不会制造出药物,‘不’也永远不会让任何人变得更好。”他们开始使用亨廷顿病小鼠模型进行探索性研究,亨廷顿病是 ASO 的明显候选者,因为它与特定的突变直接相关。亨廷顿病患者携带 CAG 三联体碱基对的重复序列,这会导致毒性水平的亨廷顿蛋白,并导致脑细胞的进行性分解。在小鼠中,贝内特和他的同事发现他们可以降低突变蛋白的水平。“小鼠实际上有所改善,”贝内特说。
与此同时,克雷纳正在研究 SMA。其他人发现,健康人有两种版本的关键运动神经元基因,SMN1 和 SMN2,但后者产生的有功能 SMN 蛋白很少。SMA 患者没有功能性 SMN1 基因,而他们损坏的 SMN2 副本本身无法完成这项工作。DNA 片段包括“外显子”(表达的编码序列,因此名称中带有“外”字)和“内含子”(外显子之间的非编码片段)。一个称为 RNA 剪接的过程将外显子连接在一起并丢弃内含子。SMN2 基因有一种变异,它通过导致特定的编码块,外显子 7 被忽略,从而使其失活。克雷纳和贝内特推测,ASO 可以迫使包含该指令块。到 2008 年,他们已经证明,他们创建的 ASO 在小鼠中通过修复剪接缺陷而发挥作用。随后进行了人体临床试验。
“这就是所谓的疾病修饰疗法,”克雷纳在谈到 Spinraza 时说。“它不仅仅是处理一些症状。它深入到疾病的根源并改变其进程。”早期干预至关重要。像艾玛·拉尔森这样出现症状的人已经失去了一些运动神经元,这些神经元无法恢复。但治疗可以防止剩余的神经元死亡并改善运动功能。在治疗婴儿方面取得的成功促使人们推动新生儿 SMA 筛查,现在 16 个州都在进行筛查。“相对于出生或疾病发作,你越早开始治疗,你就能取得越多的成就,”克雷纳说。
Spinraza 的临床成功表明,与预期相反,反义疗法可能对脑部疾病特别有效。神经系统靶点已“成为唾手可得的果实”,Aartsma-Rus 说。例如,几种基于 ASO 的疗法正在开发用于治疗亨廷顿病。其中一种名为 RG6042 的药物由 Ionis 和 Roche 开发,目前正处于 3 期临床试验阶段。Roche 全球亨廷顿病 ASO 项目的临床科学负责人斯科特·肖贝尔说,早期的安全性和耐受性研究表明,有可能降低突变蛋白的水平,但“现在重要的是它的临床意义是什么?”当前的试验应该可以回答这个问题。“我们认为,即使减缓 30% 的衰退也是一场胜利,”肖贝尔说。这相当于在患者仍然有功能的情况下,每年给他们争取回三到四个月的时间。
ALS 也被称为卢伽雷氏症,它更为复杂,因为最多 10% 的病例具有明显的遗传原因,并在家族中遗传。最常见的遗传形式是由一种名为 C9orf72 的基因突变引起的;另一种基因 SOD1 导致约 20% 的家族性病例。这些仅占所有病例的一小部分,但反义疗法的希望为以前几乎没有希望的地方注入了新的希望。“我的心情非常高涨,”ALS 研究员布朗说,他领导的团队在 1993 年鉴定了 SOD1。用于治疗 C9orf72 和 SOD1 形式疾病的反义药物的临床试验正在进行中。这些药物已被证明是安全且耐受性良好的,并且可以抑制突变蛋白的活性。
让布朗等临床医生如此兴奋的部分原因是,反义疗法还使得为个体患者开发药物成为可能。一位名叫贾西·赫姆斯塔德的年轻爱荷华州妇女,她患有一种非常罕见的 ALS,由一种名为 FUS 的基因突变引起,她于 2019 年夏天开始服用为她量身定制的药物。到目前为止,她的耐受性良好,并且出现了一些小的改善,例如她重新获得了移动手臂的能力。
米拉的药物
在波士顿儿童医院的神经学家蒂莫西·于在不到一年的时间(创纪录的时间)内为现年九岁的米拉·马科韦克创造了一种药物之前,仅为一个人的药物是科幻小说。米拉患有一种超罕见的疾病,称为巴滕病,它实际上是一系列疾病,其中突变导致蛋白质和脂质在细胞中积聚。患有巴滕病的儿童很少能活到青春期。
像许多巴滕病患者一样,米拉早期非常协调且口齿伶俐。但在三岁时,她的脚趾开始向内转。在四岁到五岁之间,她变得笨拙,并开始失去视力。科罗拉多州儿童医院的医生最终将米拉的症状与她携带的一种巴滕病基因突变联系起来。
但巴滕病需要两个基因突变。米拉的母亲朱莉娅·维塔雷洛开始寻找能够完全测序米拉基因组的人,以确认诊断。她和米拉的父亲也想知道他们的幼子阿兹兰是否有风险。2017 年 1 月,她的请求通过社交媒体传达到了于的妻子那里。
于的团队进行了测序,并找到了缺失的第二个突变。它是由跳跃基因或转座子引起的,转座子是一段核苷酸序列,它复制并移动到基因组中不属于它的位置。这一发现意味着阿兹兰是安全的。这也给了于一个想法:有可能为米拉创造一种药物。“我们意识到我们可以使用 Spinraza 的技巧,”于说。“但是,我们不是使用反义寡核苷酸来迫使被忽略的外显子包含在内,而是使用反义寡核苷酸来关闭阻碍的外显子。”
在几家制药公司拒绝后,于亲自监督了药物的生产。维塔雷洛为寻找治疗方法筹集的 300 万美元中的一部分用于该项目(她不愿具体说明金额)。于将该药物命名为米拉森,仅供唯一一位患者使用,米拉在 2018 年 1 月接受了她的第一剂药物。那时她已经失明,每天发作 20 到 30 次癫痫,有些持续数分钟。对米拉身体造成的损害已经无法修复,但经过治疗,她的癫痫发作很快就缓解了。四五个月后,癫痫发作持续的时间只有几秒钟,而不是几分钟。维塔雷洛说,最近,在她的帮助下,米拉甚至可以交替双脚走上楼梯。
当于在 2019 年末在《新英格兰医学杂志》上报道米拉的故事时,它成为了头条新闻。它也引发了人们对为一个人开发药物的成本和伦理的担忧。(于的机构审查委员会和 FDA 都批准了米拉森。)生物伦理学家萨拉·戈尔德金德曾是 FDA 工作人员,也是罕见疾病项目的顾问和米拉森的顾问,她说,在这种不寻常的情况下,该过程至关重要。仍然必须进行安全性和有效性测试,但也存在许多减轻情况——这些是罕见、致命且快速进展的疾病,没有治疗方法——这可能允许 FDA 依赖一项充分且对照良好的研究,而不是通常需要的两项研究。“在如何应用法规方面需要一些灵活的思维,”戈尔德金德说。
克鲁克已经从 Ionis 的日常运营中退下来,他成立了一个基金会,以支持为影响人数太少而无法在商业上生存的超罕见疾病开发定制的反义药物。维塔雷洛和于也希望让个人化治疗对所有像米拉这样的孩子都可用。反义疗法的一大优势是,尽管在 Spinraza 和米拉森上花费了大量资金,但这种个性化药物不仅可以快速创建,而且成本相对较低。
火烈鸟艾玛
像米拉一样,艾玛·拉尔森也没有被治愈。她失去的神经元没有被替换,而且她的骨骼变化可能是永久性的。在拉尔森家,有大片未铺地毯的木地板,这更适合刚满七岁的艾玛在她称为赛车的轮椅上飞驰。她上一年级,她一天中最喜欢的部分是课间休息,那时她喜欢玩滑梯和跷跷板。
当轮椅停好后,她的父母会把她从一个房间抱到另一个房间。她在她的游戏室里爬来爬去,炫耀她最喜欢的玩具,一个波莉口袋购物中心。但是,当她的助行器和支具连接到一双闪亮的粉红色运动鞋时,艾玛可以靠自己的力量走几步。在餐厅里,她一只手扶着桌子,像火烈鸟一样站在靠墙的长凳上,并喊道:“嘿,看,单腿站立!”
拉尔森夫妇承认,生活仍然很艰难,但他们不再绝望。他们希望艾玛能够独立生活。他们对服用 Spinraza 的新生儿状况良好感到非常兴奋。“这让我的内心充满了喜悦,”黛安眼眶湿润地说。“在某些方面,这对艾玛来说有点晚了,但她为那些小婴儿铺平了道路。”
图片来源:梅萨·舒马赫
*编者注(20 年 4 月 17 日):此段已在发布后经过编辑,删除了对一家追求反义疗法的公司的错误引用。

