几十年来,公共卫生官员认为寨卡病毒只会引起人们相对轻微的疾病。然而,自从 2015 年巴西爆发疫情以来,人们已经清楚地认识到,该病毒可以从孕妇传播给胎儿,并造成毁灭性的后果。该病毒会导致一些未出生的孩子死亡,并使另一些孩子遭受严重的脑损伤,包括头部比正常小(一种称为小头畸形的疾病)。病毒如何到达胎儿仍然是一个谜,因为要到达那里,它必须穿过胎盘,胎盘是一个盘状器官,连接着发育中的婴儿和母亲,并且设法阻止其他密切相关的蚊媒病毒(如登革热和黄热病)从母亲传播给婴儿。
在过去的几年里,这个谜题和其他谜题引起了人们对胎盘的新研究关注,胎盘是受孕后第一个也是最大的发育器官。它是胚胎的产物,而不是母亲的产物,除其他外,它为胎儿提供营养和氧气,并处理废物。然而,尽管胎盘在妊娠中起着至关重要的作用,但它可以说是人体中最不被了解的器官。
胎盘对寨卡病毒的脆弱性并不是唯一的难题。研究人员长期以来一直想知道,为什么母亲的免疫系统不将胎盘和胎儿识别为基因外来物,从而将它们作为攻击目标。事实上,母亲的免疫系统不仅会自我抑制,还会帮助胎盘的正常发育和功能。
支持科学新闻报道
如果您喜欢这篇文章,请考虑通过以下方式支持我们屡获殊荣的新闻报道 订阅。通过购买订阅,您正在帮助确保有关塑造我们当今世界的发现和想法的具有影响力的故事的未来。
我们实验室和其他实验室进行的研究已经开始对这些问题产生有趣的见解。通过这些发现,我们越来越意识到,某些妊娠并发症——曾经被认为完全是由母亲身体的问题引起的——实际上归因于胎盘或其与子宫相互作用的缺陷。更重要的是,胎盘的细微变化可能会影响一个人以后的生活健康。
快速发育
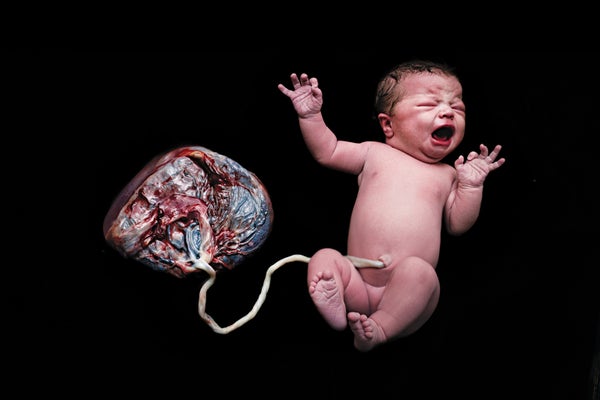
虽然与胎盘相关的谜团很多,但有两个方面是众所周知的:器官的结构及其发育的基本步骤。在分娩时,板状胎盘重量刚超过一磅,并且有两个不同的面:分娩前附着在母亲子宫壁上的部分,看起来像浸透血液的海绵,以及面向婴儿的部分,其中包含穿过脐带的大量血管 [见下图]。

胎盘的这一面,在出生后与脐带一起显示,在怀孕期间面向婴儿。另一面,类似于充满血液的海绵,附着在母亲的子宫壁上。图片来源:Norm Barker
胎盘发育迅速,因为它必须在其他发育中的器官完全发挥功能之前完成它们的工作——像肝脏一样,它代谢营养物质;像肺一样,它交换氧气和二氧化碳;像肾脏一样,它排泄废物。在精子使卵子受精后不到一周,称为滋养层细胞的特殊细胞就会在胚胎表面出现。这些细胞的首要任务(它们也产生激素,提醒母亲身体胚胎的存在)是钻入子宫壁。在那里,滋养层细胞迅速分裂,形成向子宫辐射的突起。一层由称为细胞滋养层细胞的细胞组成。另一层融合细胞(称为合体滋养层细胞)成为胎盘的表面。最终,胎盘呈现出圆盘状,通过分支结构附着在子宫壁上。
在受精后的第二周和第三周,这些分支开始充满支持细胞和血管。到女性得知自己怀孕的时候,这些结构(现在称为绒毛)的成熟构型已经建立。
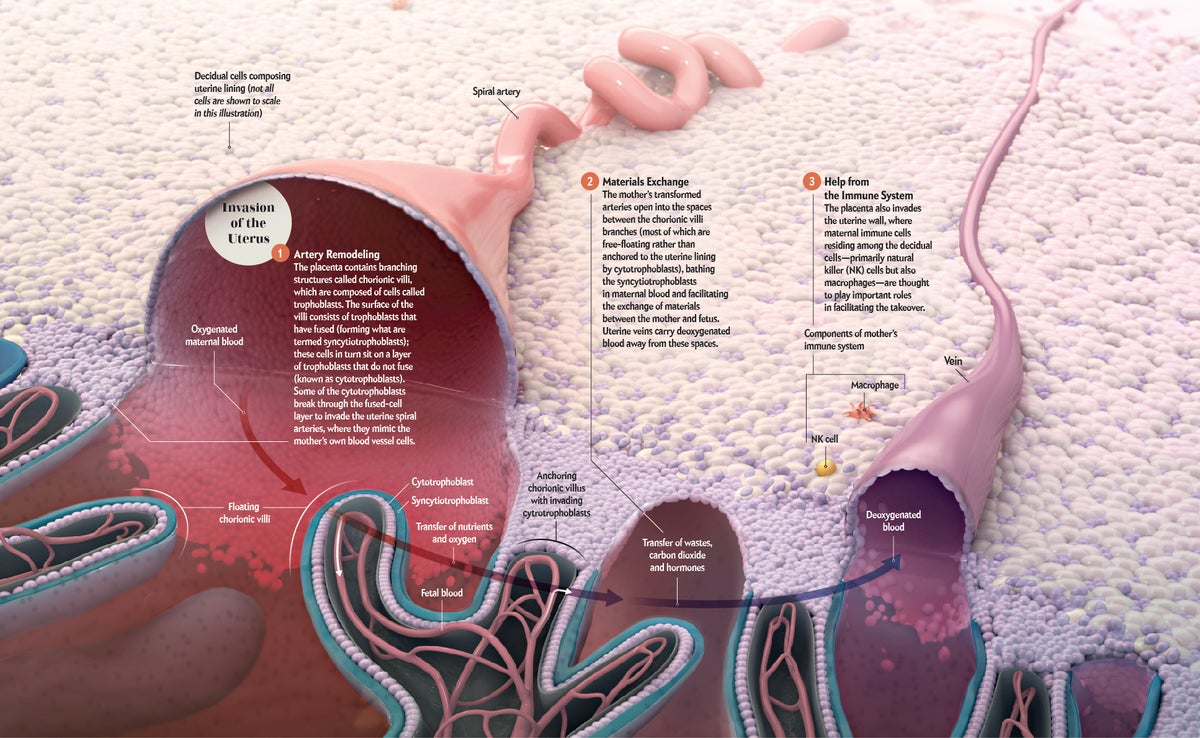
在胎盘与时间赛跑以在妊娠早期完全发挥功能的过程中,其将母体血液重新定向到自身的能力至关重要。细胞滋养层细胞的非凡旅程使这一壮举成为可能。首先,细胞将自身附着在子宫壁表面,然后它们迁移到更深处。大约二十年前,我们中的一位(Fisher)发现细胞滋养层细胞在此过程中会发生转变,从而模仿通常排列在血管内的细胞。这种模仿使细胞滋养层细胞能够突破母亲富含氧气的动脉 [见下图]。一旦进入内部,它们就会沿着每根血管的内层向上爬,并在前进过程中替换它。
由于细胞的诡计,母亲子宫内的动脉扩张并失去正常的“张力”,否则这种张力会限制它们可以携带的血液量。到妊娠早期结束时,动脉会流入绒毛之间的空间,输送后代生长所需的大量母体血液(以及营养物质和氧气)。细胞滋养层细胞还会侵入子宫静脉,使血液从胎盘流回母亲的身体,从而完成循环,并将二氧化碳和其他废物从胎儿体内带走。
.png?w=900)
图片来源:AXS Biomedical Studio;Susan J. Fisher 惠赠(显微照片)
图片来源:AXS Biomedical Studio;Susan J. Fisher 惠赠(显微照片)
来自母亲动脉的血液沐浴着胎盘表面,距离后代自身的血管只有几层细胞。这种接近度最大限度地提高了营养物质、气体和废物的交换。研究人员在过去几年中还确定,胎盘会释放大量的后代 DNA 进入母体血液,这使得仅需采集母亲的血液样本即可进行产前基因检测。此类检测正在迅速取代较旧、侵入性更强的程序,如绒毛膜绒毛取样术和羊膜穿刺术。
环境影响
胎儿的基因指导着胎盘的大部分发育,但器官周围的微环境也起着至关重要的作用。过去二十年的研究已经开始揭示成功的妊娠在多大程度上依赖于子宫组织中母体细胞与胎盘侵入性分支之间的相互作用。胎盘和子宫相遇的区域——所谓的母胎界面——容纳着各种称为白细胞的免疫细胞,这些细胞从母亲的血液迁移到该部位。来自胎儿的滋养层细胞与这些白细胞和其他子宫细胞保持持续的对话,以保持胎盘正常工作。
母体免疫细胞的行为令人惊讶。胎盘一半的基因来自父亲,本质上对母亲来说是外来的。这种外来性提出了一个问题,即胎盘如何逃脱免疫过程的排斥,否则免疫过程会识别并摧毁这种入侵者,就像传统的器官移植一样。研究人员现在知道,母亲免疫系统的变化有助于她“耐受”胎盘。子宫内发生的局部过程也发挥着作用。例如,我们中的一位(Erlebacher)于 2012 年发表的关于小鼠的研究表明,通常排斥器官移植的白细胞无法在入侵胎盘附近的子宫壁中积聚。
然而,母亲的身体不仅仅是耐受胎盘。它还积极促进胎儿组织的侵入性生长。例如,从 20 世纪 80 年代开始,研究人员发现一种称为自然杀伤细胞的白细胞在母胎界面的子宫侧大量存在。一般来说,这些特殊细胞会杀死肿瘤和病毒感染的细胞。但在 20 世纪 90 年代,由安大略省皇后大学的 B. Anne Croy 领导的研究人员做出了与直觉相反的发现,即自然杀伤细胞也支持胎盘发育——特别是细胞滋养层细胞对子宫动脉的重塑。据推测,子宫自然杀伤细胞产生促进动脉内层原始母体细胞丧失的物质,从而促进胎盘细胞随后接管这些血管。
界面问题
鉴于胎盘发育的快速节奏以及构成胎盘和子宫壁的多种细胞类型,母胎界面形成过程中可能会出现错误,这也许不足为奇。这些错误会导致各种妊娠并发症,其中最重要的是所谓的“重大产科综合征”。它们包括早产(妊娠 37 周前分娩)、宫内生长受限(婴儿比预期的小)和先兆子痫(母亲突然出现高血压和血管损伤)。
最近对胎盘的研究有助于阐明其中一些疾病的起源。例如,先兆子痫曾经被称为妊娠毒血症:医生认为它的发生是因为胎盘向母亲的血液中释放毒素。尽管导致先兆子痫(影响约 8% 的初次妊娠)的确切机制仍然未知,但研究人员发现它与母胎界面的明显结构畸形有关。专家现在认为,这种情况源于妊娠前半期细胞滋养层细胞对子宫动脉的侵入不足。血液供应不足限制了胎儿的生长。最终,异常发育的胎盘确实会释放对母亲有毒的物质,特别是对她的循环系统,但这些毒素似乎不是根本原因,正如之前认为的那样。相反,它们很可能是该疾病的后果。如果不及时治疗,先兆子痫可能会对母亲和孩子造成严重甚至致命的损害。

五周大的胎盘已经具有分支结构,但相对苍白,因为它尚未被母亲的血液灌注。这个胎盘来自流产的妊娠;正常情况下,在这个阶段它会完全包围胚胎及其羊膜囊。图片来源:Joo Lee Getty Images
在先兆子痫病例中,胎盘为何无法正常工作仍然不清楚。功能障碍可能发生在细胞滋养层细胞或各种母体细胞内部,或两者兼而有之。有趣的是,自然杀伤细胞检测外来组织的能力可能是一个促成因素。剑桥大学生殖免疫学专家 Ashley Moffett 进行的研究表明,如果胎盘和母亲在免疫学上过于相似,自然杀伤细胞可能无法充分支持用胎盘细胞替换子宫动脉内层的母体细胞。
另一种重大产科综合征——早产——最近敲响了警钟,因为其发病率在全球范围内都在上升。根据疾病控制和预防中心的数据,这种疾病现在影响着美国大约十分之一的妊娠。虽然宫内感染会引发早产,但许多早产没有明确的原因。事实上,科学家仍然不明白是什么引发了妊娠末期的正常分娩,这是人类生物学中尚未解决的主要问题之一。据推测,一个“时钟”计算着人类妊娠的 280 天。我们知道,当警报响起时,它会在子宫内引发炎症级联反应,这可能是子宫收缩和分娩的直接原因。但时钟在哪里滴答作响?是在胎儿、胎盘还是子宫中?很容易想象,妊娠早期的胎盘发育缺陷可能会阻碍分娩时钟的内部运作,尽管这种想法仍然是推测性的。
重大产科综合征在症状和潜在机制上存在重叠。例如,细胞滋养层细胞的浅层侵入与先兆子痫始终相关,这也是宫内生长受限和某些早产病例的一个特征。更好地理解母胎界面的问题如何演变成非常不同的并发症,可能会为更有效地干预提供思路。
持久的影响
这种重大的妊娠不规则会对新生儿产生明显的有害影响,从需要在新生儿重症监护病房住院治疗的可治疗疾病到永久性神经功能障碍。胎儿生长环境不足带来的不良影响并不会随着婴儿期的结束而结束;它们可能会在几十年后表现为成人疾病,并且有理由相信胎盘功能缺陷也在此处发挥作用。
子宫内的状况会影响以后生活健康的观点被称为胎儿起源假说。它最初由已故的英国流行病学家 David Barker 在 20 世纪 80 年代提出,试图解释英格兰贫困地区心血管疾病和糖尿病的高发率。Barker 指出,患有这些慢性疾病的成年人更有可能在出生时体重不足,这可能反映了营养状况不佳。一些研究人员认为,营养不良和胎盘功能障碍可能会改变婴儿基因在妊娠期间指导其发育的方式——但这种过程背后的机制尚不清楚。流行病学证据也强烈表明,在怀孕期间感染某些感染(如流感病毒)的妇女所生的孩子患神经发育和精神疾病(包括自闭症、躁郁症和精神分裂症)的风险增加。
纽约大学的免疫学家 Dan R. Littman 和马萨诸塞大学医学院的 Jun R. Huh 于 2016 年发表的一项小鼠研究表明,流感感染可能如何在微妙地改变大脑发育的进程,而这种改变只有在数年或数十年后才会显现出来。此前,科学家们知道,导致怀孕小鼠全身炎症的病毒模拟剂也会导致其后代出现类似自闭症的行为。Littman、Huh 及其同事表明,引起炎症的物质是白细胞介素-17 (IL-17),并且它是由母亲的免疫细胞产生的。该团队使用先进的成像技术表明,该蛋白质直接导致了受影响小鼠大脑的细微结构变化。
但是,当许多其他大小相似的分子无法通过时,母体 IL-17 如何穿过胎盘到达胎儿大脑?一种可能性是,出于某种原因,胎盘主动将 IL-17 从母体血液转运到胎儿循环系统,使其能够进入大脑。另一种有趣的可能是,一些产生 IL-17 的母体细胞本身穿过胎盘到达胎儿。
跨越
寨卡病毒大流行生动地说明了当感染母亲的病毒学会如何穿过胎盘时可能造成的损害。然而,目前,研究人员对寨卡病毒如何引起受感染婴儿出现的健康问题存在疑问多于答案。
鉴于研究人员最近才将妊娠期间的寨卡病毒感染与不良后果联系起来,因此对于寨卡病毒如何到达胎儿知之甚少也就不足为奇了。即使是出生缺陷率也不清楚,并且似乎因地区而异。在 2017 年 1 月发表在 JAMA 上的一项美国研究中,公共卫生部门和 CDC 的研究人员发现,在可能感染寨卡病毒的母亲的胎儿或婴儿中,只有 6% 出现出生缺陷。然而,巴西在新英格兰医学杂志上发表的前一个月的一项研究表明,几乎一半的受感染胎儿可能患有某种形式的损害。此外,一些巴西婴儿最初被评估为正常,但后来出现了神经系统问题。由于寨卡病毒最具破坏性的影响——特别是小头畸形——在巴西似乎比其他地方更普遍,因此一些研究人员推测,巴西环境中的一种化学物质可能会削弱胎盘,使其更容易感染寨卡病毒。或者,同时感染巴西流行的另一种微生物可能是罪魁祸首。
寨卡病毒如何到达胎儿也是一个问题。它是从母体侧犁过胎盘,感染沿途的每种细胞类型,还是由特定细胞类型(如母体免疫细胞)护送?或者,我们知道某些病原体可以从阴道上升到子宫,从而进入胎儿组织。无论寨卡病毒如何到达胎儿组织,一旦到达那里,它就会在那里站稳脚跟:CDC 的分子病理学家报告说,寨卡病毒可以在胎盘中持续存在数月,并且即使在出生后仍可能继续在婴儿的大脑中复制。
当然,寨卡病毒并不是唯一可以穿过胎盘并损害胎儿的病原体。在全球范围内,估计每年有 10 万名婴儿出生时患有先天性风疹,这会导致耳聋、眼睛异常、心脏病和其他严重问题。疟疾、疱疹和埃博拉病毒都可能在妊娠期间造成致命损害。它们入侵胎儿的确切方式仍有待确定。但这似乎表明,有些病原体更能够感染胎盘的滋养层细胞,尤其是在妊娠早期。母胎界面的免疫防御机制有时也可能是糟糕的把关人,因为子宫内膜本身就承担着两个内在矛盾的工作。一方面,它必须保护胎儿和胎盘免受感染。另一方面,如前所述,它必须防止母体免疫反应变得过于强烈以致损害胎盘。
由于关于胎盘和妊娠还有很多东西要学习,尤尼斯·肯尼迪·施莱佛国家儿童健康与人类发育研究所三年前启动了人类胎盘项目,该项目旨在了解这个神秘的器官,“它不仅影响女性及其胎儿在妊娠期间的健康,还影响两者终生的健康。”与治愈艾滋病毒、癌症和心血管疾病的努力一样,了解胎盘应在国家健康研究议程上给予最高优先权。