弗朗西斯科·莫吉卡并不是第一个看到 CRISPR 的人,但他可能是第一个被它迷住的人。他记得 1992 年的那一天,他第一次瞥见了这种将引发生物技术革命的微生物免疫系统。他当时正在审查嗜盐微生物地中海盐杆菌的基因组序列数据,并注意到 14 个不寻常的 DNA 序列,每个序列长 30 个碱基。它们的正向和反向读取大致相同,并且每隔约 35 个碱基重复一次。很快,他又看到了更多。莫吉卡被迷住了,并将这些重复序列作为他在西班牙阿利坎特大学的研究重点。
这不是一个受欢迎的决定。他的实验室多年没有获得资金。在会议上,莫吉卡会抓住他能找到的最大人物,询问他们对这些奇怪的小重复序列的看法。“不要太在意重复序列,”他说他们会警告他。“许多生物体中都有许多重复序列——我们已经了解它们多年了,但仍然不知道其中有多少在起作用。”
今天,人们对赋予 CRISPR 其名称的成簇的、有规律间隔的短回文重复序列以及 CRISPR-Cas 微生物免疫系统如何摧毁入侵病毒的了解要多得多。但是,尽管生物医学领域的大多数人已经开始敬畏该系统的机制(特别是称为 CRISPR-Cas9 的版本)因为它能被用来编辑基因,但莫吉卡和其他微生物学家仍在研究有关该系统及其工作原理的一些基本问题。它是如何进化的,它又是如何塑造微生物进化的?为什么一些微生物使用它,而另一些微生物不使用?它是否在其基本的生物学中具有其他尚未被认识到的作用?
关于支持科学新闻
如果您喜欢这篇文章,请考虑通过 订阅来支持我们屡获殊荣的新闻报道。通过购买订阅,您正在帮助确保未来对塑造我们当今世界的发现和想法进行有影响力的报道。
“媒体对 CRISPR 系统的关注大多集中在它作为一种技术上的应用——这是有充分理由的。我们正在看到惊人的影响和机会,”加州大学伯克利分校的分子生物学家 Jennifer Doudna 说,她是第一批揭示 CRISPR-Cas 作为基因编辑工具的敏捷性的科学家之一。“与此同时,还有许多有趣的关于基础生物学的研究要做。”
它从何而来?
像 CRISPR-Cas 这样的东西的生物学优势是显而易见的。原核生物——细菌和鲜为人知的单细胞生物,称为古菌,其中许多生活在极端环境中——面临着遗传入侵者的不断袭击。病毒的数量是原核生物的十倍,据说每两天杀死世界上一半的细菌。原核生物还会交换称为质粒的 DNA 片段,这些质粒可能是寄生的——耗尽宿主的资源,如果宿主试图驱逐它的分子搭便车者,就会迫使其自我毁灭。似乎没有安全的地方:从土壤到海洋,再到地球上最不适宜居住的地方,都存在着遗传入侵者。
原核生物已经进化出大量武器来应对这些威胁。例如,限制性酶是蛋白质,可以在特定序列处或附近切割 DNA。但是这些防御措施是迟钝的。每种酶都被编程为识别特定序列,只有当微生物具有正确的基因副本时,它才能受到保护。CRISPR-Cas 更具动态性。它会适应并记住特定的遗传入侵者,类似于人类抗体在感染后提供长期免疫的方式。“当我们第一次听到这个假设时,我们认为对于简单的原核生物来说,这太过复杂了,”荷兰瓦赫宁根大学的微生物学家约翰·范德·奥斯特说。
当莫吉卡和其他人看到 CRISPR 回文重复序列之间的 DNA 有时与病毒基因组中的序列匹配时,他们推断出 CRISPR-Cas 的功能。此后,研究人员已经弄清楚,某些 CRISPR 相关(Cas)蛋白质会在细菌和古菌暴露于特定病毒或质粒后,将这些间隔序列添加到基因组中。由这些间隔序列制成的 RNA 会引导其他 Cas 蛋白质吞噬任何与该序列匹配的入侵 DNA 或 RNA(请参阅'持久保护')。
细菌和古菌是如何拥有如此复杂的免疫系统的?这个问题尚未得到解答,但主要的理论是该系统来源于转座子——可以在基因组中从一个位置跳到另一个位置的“跳跃基因”。美国马里兰州贝塞斯达美国国立卫生研究院的进化生物学家尤金·库宁和他的同事们发现1一类编码 Cas1 蛋白质的移动遗传元件,该蛋白质参与将间隔子插入基因组。他认为,这些“casposons”可能是 CRISPR-Cas 免疫的起源。研究人员现在正在努力了解这些 DNA 片段是如何从一个位置跳到另一个位置的,然后追踪这种机制是如何导致 CRISPR-Cas 的复杂性的。
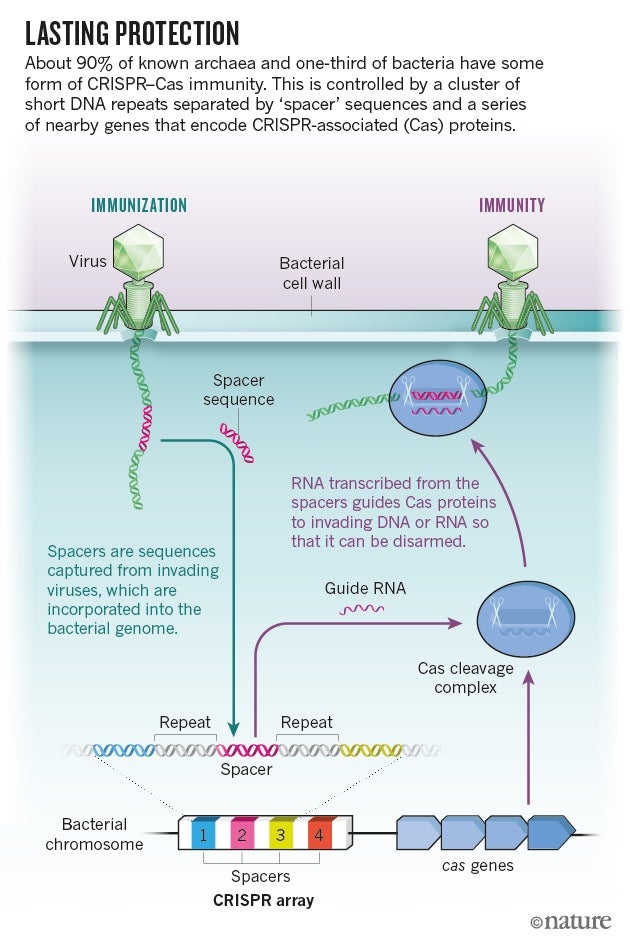
图片来源:NIK Spencer/Nature
它是如何工作的?
近年来,Cas 蛋白质如何添加间隔子的许多分子细节已被精细地研究出来2。但是,病毒 DNA 在化学上与宿主 DNA 几乎相同。在细胞中充满了 DNA 的情况下,这些蛋白质如何知道要将哪些 DNA 添加到 CRISPR-Cas 记忆中?
风险很高:立陶宛维尔纽斯大学的生物化学家 Virginijus Siksnys 说,如果细菌添加了它自己的 DNA 片段,它可能会因自身免疫攻击而自杀。“这些酶是一把双刃剑。”
北卡罗来纳州立大学罗利分校的微生物学家 Rodolphe Barrangou 说,细菌和古菌种群可能会吸收一些错误。如果其他细胞在病毒攻击后能够茁壮成长,那么一些细胞的自杀可能无关紧要。
事实上,当病毒渗透到细菌生态系统中时,通常只有约 1000 万个细菌中的一个会获得一个能够让它自我防御的间隔子。这些几率使得很难研究是什么驱动了间隔子的获取,也很难了解为什么一个细胞成功了,而其他细胞失败了。“当它真正发生时,很难抓住那个细菌,”纽约市洛克菲勒大学的微生物学家卢西亚诺·马拉菲尼说。
弄清楚如何识别合适的间隔子——并提高它们被整合的速率——可能会很有用。一些研究表明,含有 CRISPR-Cas 机制的细胞可以作为一种记录设备,记录它们遇到的 DNA 和 RNA 序列3。这可能使研究人员能够追踪细胞的基因表达或长期接触环境化学物质的情况。
研究人员还想了解如何从集合中修剪旧记忆。大多数具有 CRISPR-Cas 系统的微生物包含几十个间隔子;有些只有一个。相比之下,古菌托氏硫化叶菌将其基因组的 1% 用于其 5 个 CRISPR-Cas 系统,其中包括 458 个间隔子。
保留旧的间隔子可能没有多少动力:如果病毒发生突变以避免 CRISPR-Cas,那么间隔子就会过时。而且微生物保留额外的 DNA 可能是一种负担。“细菌不可能永远膨胀它的基因组,”以色列雷霍沃特魏茨曼科学研究所的遗传学家罗滕·索雷克说。
它还能做什么?
一些间隔子的起源提出了另一个谜团。到目前为止观察到的间隔子中,只有不到 3% 与 DNA 数据库中的任何已知序列匹配。
这可能反映了对病毒的了解甚少。大多数测序工作都集中在那些感染人类、牲畜或农作物的病毒上。“我们对细菌的敌人,特别是疯狂古菌的敌人知之甚少,”佐治亚大学雅典分校的 RNA 生物学家迈克尔·特恩斯说。
还有可能一些间隔子是已经不存在或突变到无法识别的病毒的幽灵。但第三种可能性让该领域议论纷纷。研究人员已经发现了 CRISPR-Cas 系统除了抵御遗传入侵者之外的其他作用的例子。在一些细菌中,CRISPR-Cas 成分控制着 DNA 修复、基因表达和生物膜的形成。它们还可以决定细菌感染其他生物的能力:引起军团病(退伍军人症)的嗜肺军团菌必须具有 Cas 蛋白质 Cas2 才能感染其天然宿主阿米巴。“一个主要的问题是,除了防御之外,还有多少生物学,”马萨诸塞大学医学院伍斯特分校的分子生物学家埃里克·桑特海默说。“在未来几年里,仍然会有很多令人惊讶的事情发生。”
桑特海默补充说,这与发现 RNA 干扰(一种在植物、动物和其他非原核生物中沉默基因表达的系统)形成了一个诱人的平行。RNA 干扰早期也被主要认为是防御机制,只是后来研究人员才注意到它在调节宿主基因表达中的作用。
荷兰代尔夫特理工大学的微生物学家斯坦·布劳恩斯说,这也可以解释为什么一些间隔子与已知的病毒或质粒不匹配。“这些系统并非旨在做到完美:它们会抓住病毒 DNA 以及它们自己的 DNA,”他说。“一旦它们开始拉入新的 DNA 片段,它们就可以获得新的功能——如果它们没有死亡的话。”
为什么只有一些微生物使用它?
无论 CRISPR-Cas 还有其他什么功能,很明显,一些微生物比其他微生物使用它的频率更高。库宁说,超过 90% 的古菌具有基于 CRISPR 的免疫力,而只有大约三分之一的已测序细菌会费心使用它。而且,没有非原核生物,即使是单细胞生物,也被发现使用 CRISPR-Cas。
一种名为微型古菌的古菌,以寄生的形式生活在近沸腾水中的另一种古菌上,并且已经放弃了许多与其能量产生和一般细胞维护相关的基因。然而,在其微小的 49 万个字母的 DNA 指令手册中,微型古菌保留了一个包含约 30 个间隔子的 CRISPR-Cas 系统。“它基因组的很大一部分仍然致力于 CRISPR,”英国圣安德鲁斯大学的分子生物学家马尔科姆·怀特说。“CRISPR 一定非常重要,但我们真的不知道为什么。”
埃克塞特大学佩恩林校区的微生物学家埃德泽·韦斯特拉表示,这些差异表明,存在一些关键的生态因素有利于CRISPR-Cas系统,这些因素会优先考虑病毒防御或其他好处,而不是细胞自杀的风险。极端环境似乎有利于CRISPR-Cas系统,但韦斯特拉指出,这种系统的频率在更适宜栖息地的细菌中也存在差异。例如,鸟类病原体鸡败血支原体在从鸡转移到野生雀类时,就抛弃了它的CRISPR-Cas设备。韦斯特拉说,为什么该系统在鸡身上有用,而在雀类身上却没用,这谁也说不准。
数学模型和一些早期的实验室实验表明,当需要对抗的病毒类型很少时,CRISPR-Cas可能更具优势4, 5。CRISPR-Cas间隔序列可以在新增DNA成为基因组负担之前记录有限数量的病毒序列。库宁说,如果环境中病毒的多样性大大超过了可能的间隔序列的数量,那么CRISPR-Cas系统可能就没什么用处。另一种可能性是,极端环境中的古菌不能过分依赖其他防御手段。细菌击退入侵者的一种常见方法是突变其自身外壳(称为包膜)中的蛋白质。然而,一些古菌可能没有太多的自由来调整这些包膜,因为包膜的结构对于生物在恶劣条件下的生存至关重要。莫吉卡说:“这使得像CRISPR这样的替代系统更加重要。”
CRISPR-Cas有多少种类型?
人类倾向于关注CRISPR-Cas9系统,该系统因其在基因组编辑中的简单性和多功能性而备受推崇,但微生物却不会偏爱任何一种。相反,它们倾向于混合搭配不同的系统,从其他细菌中快速获取新的系统并抛弃旧的系统。
研究人员已经正式认可了6种不同类型的CRISPR系统,以及19种亚型。“而且我们实际上只知道其中一小部分的实际工作原理,”马拉菲尼说。
揭开这些机制的谜团可能会成为寻找CRISPR-Cas系统新生物技术应用的关键。例如,备受青睐的CRISPR-Cas9是一种II型系统,它利用从间隔序列转录的RNA分子来指导酶切割入侵的病毒或质粒DNA。但去年发现的VI型系统中的酶6会切割RNA,而不是DNA。而IV型系统包含一些与CRISPR-Cas相关的基因,但缺乏插入间隔序列所需的重复序列和机制。
III型系统是自然界中最常见的CRISPR-Cas系统之一,也是最不为人所知的系统之一。迄今为止的证据表明,它们不是对入侵的DNA或RNA本身作出反应,而是对DNA转录成RNA的过程作出反应。如果事实证明是这样,这将是一种新的调控形式,可以扩展用于基因组编辑的CRISPR-Cas工具箱,杜德纳说。
随着研究人员将搜索范围从在培养基中生长的微生物扩展到包括来自环境DNA样本的遗传序列,可能会出现其他系统。“我们已经几次说我们已经到了终点,”范德奥斯特说,但结果每次都被新的CRISPR-Cas系统出现而感到惊讶。
对莫吉卡来说,探索这种多样性并回答有关CRISPR系统的基本问题比它们引发的革命更有吸引力。他说,这让他的许多同事感到困惑。他已经沉浸在CRISPR-Cas生物学研究中四分之一个世纪了,虽然对于那些希望编辑基因组的人来说,有很多资金可供使用,但对于他所做的那种工作,资金则少得多。
“我知道这是一个伟大的工具。它非常棒。它可以用来治疗疾病,”莫吉卡说。“但这不是我的业务。我想知道这个系统从头到尾是如何运作的。”
本文经许可转载,并于2017年1月19日首次发表。